Bình luận: Khi việc theo dõi lâm sàng cho thấy các dấu hiệu tổn thương đáng kể, việc yêu cầu tiếp theo là cần chẩn đoán chính xác tổn thương nào đó chịu trách nhiệm cho suy lưu lượng chức năng đường vào và lựa chọn được các thủ thuật điều trị phù hợp với tổn thương, Kế hoạch Sống ESKD của bệnh nhân. Hướng dẫn 15 sẽ đề cập đến vai trò của các phương pháp chẩn đoán hình ảnh trong chẩn đoán xác định và một số can thiệp điều trị như các phương pháp PTA, phẫu thuật…
Lược dịch: BSCKI Nguyễn Thanh Hùng – PTTK VDA
| Hướng dẫn 14 | Trở lại mục lục | Hướng dẫn 16 |
Tuyên bố: Chẩn đoán hình ảnh xác định các tổn thương đáng kể trên lâm sàng đường vào AV
15.1. KDOQI cân nhắc điều hợp lý rằng khi theo dõi lâm sàng nghi ngờ tổn thương đường vào AV đáng kể trên lâm sàng (như hẹp), nên kịp thời tiến hành đánh giá thêm và xác định chẩn đoán, bao gồm thăm dò hình ảnh vòng tuần hoàn đường vào mạch máu (Quan điểm chuyên gia)
Chú ý:
– Một tổn thương đáng kể trên lâm sàng là một tổn thương gây ra các dấu hiệu và triệu chứng lâm sàng (xem Theo dõi đường vào AV, Bảng 13.2) mà không gây ra các vấn đề khác (có hoặc không có thay đổi thông số thăm dò, như lưu lượng máu [Qa] hoặc áp suất tĩnh mạch).
– Tuần hoàn đường vào AV được tính một cách liên tục từ tim và động mạch dòng vào qua đường vào AV để đến tĩnh mạch dòng ra và trở lại tim.
– Khuôn khổ thời gian, lựa chọn phương pháp, và phạm vi của chẩn đoán hình ảnh để đánh giá thêm là phụ thuộc vào nguồn lực và mức độ nặng của các phát hiện qua theo dõi lâm sàng; một khuôn khổ thời gian là ít hơn 2 tuần được KDOQI Work Group cho là phù hợp.
15.2. KDOQI cân nhắc điều hợp lý với việc sử dụng thể tích của thuốc cản quang chứa iodine hoặc không chứa iodine thấp nhất (như CO2, khí gas) bởi người thực hành có kiến thức về sử dụng, chống chỉ định, và nguy cơ so với việc thu được hình ảnh tốt nhất ở toàn bộ bệnh nhân CKD để bảo tồn chức năng thận tồn dư. (Quan điểm chuyên gia)
15.3. KDOQI cân nhắc điều hợp lý rằng khi khảo sát chẩn đoán hình ảnh xác định tiết lộ tổn thương chịu trách nhiệm cho các dấu hiệu và triệu chứng lâm sàng, tổn thương đáng kể trên lâm sàng được điều trị kịp thời. (Quan điểm chuyên gia)
Chú ý: Một tổn thương đáng kể trên lâm sàng là một tổn thương gây ra các dấu hiệu và triệu chứng lâm sàng (xem Theo dõi đường vào AV, Bảng 13.2) mà không gây ra các vấn đề khác (có hoặc không có thay đổi thông số thăm dò, như lưu lượng máu [Qa] hoặc áp suất tĩnh mạch).
Tuyên bố: Điều trị chung của hẹp hoặc huyết khối đường vào AV đáng kể trên lâm sàng
15.4. KDOQI cân nhắc điều hợp lý với việc sử dụng một tiếp cận cá nhân hóa cẩn thận để điều trị AVF hoặc AVG bị hỏng hoặc huyết khối (phẩu thuật hoặc can thiệp nội mạch), dựa trên đánh giá và kinh nghiệm lâm sàng tốt nhất của người thực hành, cân nhắc đến Kế hoạch Sống ESKD của bệnh nhân. (Quan điểm chuyên gia)
Chú ý: Cân nhắc cả các trường hợp cụ thể của bệnh nhân cùng với kinh nghiệm và mức độ chuyên môn của người thực hành (như năng lực và hạn chế phù hợp); ưu tiên thảo luận và được sự đồng ý của đội quản lý đường vào mạch máu bệnh nhân, bao gồm, nhưng không hạn chế, bệnh nhân và một hoặc nhiều người sau: bác sỹ thận niệu, chuyên gia can thiệp, bác sỹ phẫu thuật, người hợp tác đường vào mạch máu, người cắm kim (điều dưỡng hoặc kỹ thuật viên).
Tuyên bố: Điều trị hẹp đường vào AV đáng kể trên lâm sàng
Nong mạch
15.5. KDOQI cân nhắc điều hợp lý với việc sử dụng bóng nong mạch (áp suất cao là cần thiết) khi điều trị ban đầu tổn thương hẹp AVF và AVG mà có triệu chứng đáng kể trên lâm sàng và trên thăm dò chẩn đoán hình ảnh mạch máu. (Quan điểm chuyên gia)
Chú ý: Hẹp trên thăm dò chẩn đoán hình ảnh mạch máu mà không đi kèm dấu hiệu và triệu chứng lâm sàng là không đủ để chỉ định điều trị hoặc can thiệp.
15.6. Không đủ bằng chứng để KDOQI tạo ra một khuyến cáo về hướng sử dụng loại bóng nong cụ thể nào (bóng nong phủ thuốc hoặc cắt) so với bóng nong áp suất cao tiêu chuẩn trong điều trị ban đầu của hẹp AVF và AVG.
15.7. Không đủ bằng chứng để KDOQI tạo ra một khuyến cáo về hướng khoảng tối ưu của thời gian lạm phát bóng nong trong quá trình nong mạch để cải thiện độ thông thoáng can thiệp chính trong điều trị hẹp AVF hoặc AVG.
15.8. KDOQI cân nhắc điều hợp lý rằng một tiếp cận cá nhân hóa bệnh nhân cẩn thận để lựa chọn loại bóng nong của hẹp AVF và AVG đáng kể trên lâm sàng dựa vào đánh giá và kinh nghiệm lâm sàng tốt nhất của người thực hành. (Quan điểm chuyên gia)
Stent
15.9. KDOQI đề nghị việc sử dụng thích hợp stent-graft tự mở ưu tiên hơn nong mạch đơn độc để điều trị hẹp miệng nối tĩnh mạch đáng kể trên lâm sàng ở AVG khi kết quả mục tiêu sau can thiệp 6 tháng nhìn chung là tốt hơn sau khi cân nhắc cẩn thận Kế hoạch Sống ESKD của bệnh nhân. (Khuyến cáo có điều kiện, chất lượng bằng chứng trung bình)
Chú ý: Sử dụng thích hợp tránh vị trí cắm kim
Chú ý: Kết quả tổng thể 6 tháng tốt hơn tham chiếu với giảm tái hẹp ± cải thiện độ thông thoáng AVG.
15.10. KDOQI cân nhắc điều hợp lý với việc cân nhắc đầu tiên đến hậu quả của đặt stent-graft trên lựa chọn đường vào AV trong tương lai theo Kế hoạch Sống ESKD của bệnh nhân, với tư vấn của đội đường vào mạch máu nếu cần, trước khi tiến hành đặt. (Quan điểm chuyên gia)
15.11. KDOQI đề nghị rằng việc sử dụng đặt một stent-graft phù hợp được ưu tiên hơn nong mạch đơn độc đối với điều trị tái hẹp sau đặt stent ở AVG và AVF đối với kết quả tổng thể sau can thiệp 6 tháng tốt hơn. (Khuyến cáo có điều kiện, chất lương bằng chứng trung bình).
Chú ý: Sử dụng thích hợp tránh vị trí cắm kim
Chú ý: Kết quả tổng thể 6 tháng tốt hơn tham chiếu với giảm tái hẹp ± cải thiện độ thông thoáng AVG
15.12. KDOQI cân nhắc điều hợp lý với việc tránh sử dụng stent kim loại trần đối với điều trị tổn thương hẹp AVF và AVG đáng kể trên lâm sàng và/hoặc chụp mạch. (Quan điểm chuyên gia)
Giải thích/Tổng quan
Duy trì chức năng đường vào AV hiệu quả (AVF và AVG) vẫn còn là một thử thách liên tục mà đồi hỏi điều trị khắc phục thường xuyên các vấn đề của đường vào AV (xem Bảng 13.2, các dấu hiệu lâm sàng [dấu hiệu và triệu chứng] gợi ý tổn thương lâm sàng đáng kể trong quá trình theo dõi đường vào), đặc biệt nếu huyết khối đường vào AV xảy ra như là một biến cố tạm thời. Nhiều vấn đề trong các điều kiện đó sẽ được chỉ ra ở từng phần riêng trong Hướng dẫn này (Hướng dẫn 16 – 19). Tiếp cận chung với các hình thái thất bại đường vào AV khác nhau đó bao gồm theo dõi và thăm dò hình ảnh phù hợp để tìm nguyên nhân và sau đó xác định điều trị tổn thương lâm sàng theo nguyên nhân. Nhiều tiếp cận nội mạch khác nhau thay thế cho tiếp cận phẫu thuật mở, các tổn thương không cần điều trị nội mạch, và các tổn thương chọn lọc với tiếp cận phẫu thuật được cho là bền vững hơn nhiều.
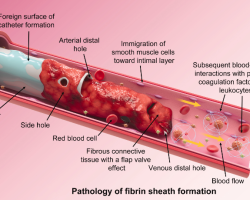
Hẹp là một biến chứng phổ biến sau phẫu thuật tạo đường vào mạch máu AV [393]. Hẹp tĩnh mạch thường là hậu quả của tăng sinh tân tạo nội mạch [394] và dẫn đến nhiều di chứng nghiêm trọng ở AVF và AVG. Hẹp dẫn đến đường vào AV không trưởng thành và tăng sử dụng CVC. Trưởng thành AVF thất bại đã được báo cáo trong các nghiên cứu quan sát nằm trong khoảng từ 20% đến 60% [77, 233, 234]. Thêm nữa, một RCT đa trung tâm ở Hoa Kỳ báo cáo lên đến 60% AVF thất bại với trưởng thành thành công để sử dụng cho lọc máu [31]. Hẹp dẫn đến suy chức năng ở AVF đã trưởng thành làm cho độ thanh thải HD không đầy đủ, huyết khối, và cả việc loại bỏ đường vào. AVG nhạy với hình thành hẹp ở miệng nối tĩnh mạch, dẫn đến huyết khối ở 80% AVG [235, 236, 238, 239, 395]. Trong Hướng dẫn KDOQI 2006, PTA như là lựa chọn điều trị đầu tiên đối với hẹp trong tuần hoàn đường vào [13]. Dù phương pháp này nhìn chung vẫn còn được sử dụng trong kỷ nguyên đường vào mạch máu hiện đại, nhiều thử nghiệm lâm sàng quan trọng và thiết bị công nghệ tiên tiến đã được cân nhắc là có thể chỉ định thay thế cho nong mạch và các loại bóng nong và stent để điều trị hẹp. Các khuyến cáo hiện nay là cập nhật từ Hướng dẫn trước.
Giải thích chi tiết
Duy trì chức năng đường vào mạch máu được yêu cầu đề cung cấp lọc máu trực tiếp theo mục tiêu HD đầy đủ là một thách thức liên tục đối với tất cả các loại và cấu hình đường vào; toàn bộ các loại đường vào mạch máu chỉ có một thời gian sống hạn chế. Biến chứng và tỷ lệ khắc phục (nhiễm trùng, nhiễm trùng toàn thân, phẫu thuật cắt huyết khối) thay đổi theo loại đường vào (số biến cố đối với CVC: 0.7 và 2.1; AVF: 0.14 – 0.44; AVG: 0.25-0.77 biến cố/năm, tương ứng) [396, 397], và đã được trình bầy chi tiết trong nhiều phần khác của Hướng dẫn này. Ngoài tỷ lệ mắc đáng kể liên quan với các biến chứng đường vào mạch máu [398], thủ thuật chẩn đoán và quản lý các vấn đề liên quan đến lưu lượng đường vào AV được coi là gánh nặng cho bệnh nhân, thường dẫn đến sự không hài lòng của bệnh nhân [345]. Đây là trách nhiệm của đội điều trị để đảm bảo phát hiện kịp thời hỏng đường vào AV và sử dụng một cách khôn ngoan các thủ thuật xâm lấn trong chẩn đoán và điều trị tổn thương. Để hiểu rõ hơn, Work Group đã thay thế thuật ngữ suy lưu lượng chức năng đường vào AV bằng 3 thuật ngữ mô tả cụ thể hơn các biến chứng đường vào: (1) Các biến chứng hoặc suy chức năng liên quan đến huyết khối; (2) Các biến chứng hoặc suy chức năng không liên quan đến huyết khối; (3) Các biến chứng hoặc suy chức năng liên quan đến nhiễm trùng (xem Bảng Chú giải). Nó phụ thuộc vào toàn bộ các nhà cung cấp dịch vụ y tế đối với bệnh nhân HD có làm quen với nhiều biến chứng và mô hình hỏng đường vào mạch máu khác nhau hay không. Điều quan trọng cần nhấn mạch rằng giảm biến chứng và hỏng đường vào mạch máu là được bắt đầu từ trước khi phẫu thuật/đặt đường vào mạch máu, với việc lựa chọn đúng bệnh nhân và lập kế hoạch đường vào mạch máu phù hợp (kế hoạch phẫu thuật tạo đường vào mạch máu), cân nhắc đến toàn bộ vòng đời của đường vào mạch máu (tính liên tục của đường vào mạch máu và kế hoạch thành công) với việc theo dõi và chăm sóc phù hợp trong đơn vị lọc máu.
Phát hiện và chẩn đoán hẹp đáng kể trên lâm sàng và các biến chứng liên quan
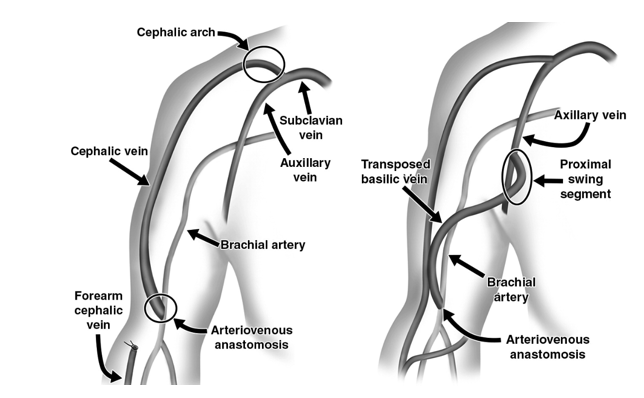
Hình 15.1. Vòm tĩnh mạch nền và đoạn bản nề của tĩnh mạch đầu chuyển vị (hình ảnh không có trong bản hướng dẫn gốc, người dịch cho thêm vào với ý định để bạn đọc nhận biết rõ hơn)
Một hẹp đáng kể trên lâm sàng trong tuần hoàn đường vào HD là liên quan đến triệu chứng và dấu hiệu bệnh nhân và có thể dẫn đến các dấu hiệu lọc máu bất thường (Bảng 13.2). Tuần hoàn đường vào mạch máu HD nên khảo sát liên tục từ tim trái, qua động mạch dòng vào, đi vào miệng nối và quay trở lại qua tĩnh mạch dòng ra (hoặc graft) để đến đến tĩnh mạch trung tâm. Các loại đường vào AV có thể hình thành tổn thương, đặc biệt là hẹp, ở bất kỳ vị trí nào trong vòng tuần hoàn này. AVG thường hình thành hẹp ở miệng nối tĩnh mạch, trong khi AVF thường hình thành hẹp ở khu vực gần miệng nối và đoạn bản lề (swing segment) đối với AVF động mạch cánh tay – tĩnh mạch nền và vòm tĩnh mạch đầu (cephalic arch) đối với AVF động mạch cánh tay – tĩnh mạch đầu [399-402]. Như đã được nói trong Hướng dẫn 15, chỉ định đánh giá thêm và xác định điều trị cần yêu cầu sự xuất hiện của triệu chứng lâm sàng, tổn thương đáng kể và không chỉ định đối với tổn thương đơn giản (hẹp không triệu chứng) [304, 404].
Khi theo dõi thường xuyên đường vào mạch máu cho biết vấn đề đường vào mạch máu quan trọng nào đó (Hướng dẫn 13), tiếp cận chẩn đoán tùy thuộc vào tổn thương lâm sàng nghi ngờ (như, động mạch dòng vào, miệng nối, tĩnh mạch dòng ra). Siêu âm Duplex là có hiệu quả để thăm dò đường vào AV từ miệng nối động mạch đến đoạn tĩnh mạch ngoại vi (hoặc graft) và có thể sơ bộ đánh giá nguyên nhân của biến chứng hoặc suy chức năng liên quan đến huyết khối như tăng sinh nội mạc tân tạo (NH), dầy van tĩnh mạch, và các tĩnh mạch nhánh cạnh tranh. Tuy nhiên, siêu âm không hiệu quả đối với tĩnh mạch trung tâm, khi mà giới hạn của siêu âm ở phạm vi này bị hạn chế và bị cản trở bởi xương của khoang ngực. Siêu âm Duplex động mạch có thể có ích để chẩn đoán hình ảnh động mạch ngoại vi nhưng lại một lần nữa bị hạn chế đối với các mạch máu ở ngực. Chụp tĩnh mạch dựa vào catheter và chụp mạch là một thủ thuật xâm lấn khi mà nó có thể cho biết hình ảnh đường vào AV từ miệng nối đến tim (hình ảnh tĩnh mạch) hoặc toàn bộ vòng tuần hoàn đường vào mạch máu (chụp động mạch) trong khi đó nó lại được sử dụng như một nền tảng cho can thiệp điều trị. CT động mạch và tĩnh mạch là một thăm dò chẩn đoán hình ảnh thay thế cho hầu hết trong các can thiệp mạch máu ngoại vi nhưng bị hạn chế trong thực hành [405]. Các thủ thuật chẩn đoán hình ảnh có thể sử dụng thuốc cản quang iodine có khả năng gây độc cho thận và nên sử dụng một cách khéo léo ở bệnh nhân CKD/ESKD còn chức năng thận tồn dư – lọc máu hoặc không. Thực vậy, lựa chọn cản quang cần được đưa vào thuật toán hình ảnh. CO2 có thể được sử dụng như một loại cản quang thay thế không độc đối với các thủ thuật dựa vào catheter trong những trường hợp chọn lọc, dù chất lượng hình ảnh có thể không đủ để hướng dẫn can thiệp, và chú ý tránh tiêm vào trong động mạch ở chi trên do khả năng đi vào tuần hoàn động mạch não và dẫn đến các biến cố thần kinh [406]. Siêu âm trong nòng mạch có thể có ích ở bệnh nhân dị ứng nặng với cản quang [407]. MRI là một thay thế cho CT mạch máu, dù kinh nghiệm công bố là hạn chế, và sử dụng cản từ gadolinium là chống chỉ định tương đối do nguy cơ xơ hóa thận [405, 408].
Một thăm dò hình ảnh tuần hoàn lọc máu phù hợp nên là phương pháp chẩn đoán hình ảnh xác định được tổn thương và đề nghị được một chiến lược điều trị. Hẹp tĩnh mạch ở vị trí tĩnh mạch ngoại vi đối với AVF và ở miệng nối đối với AVG thường được điều trị với liệu pháp nội mạch khi mà tính xâm lấn của chúng là thấp. Đáng chú ý, các hẹp đó thường là các tổn thương dầy, xơ hóa do tăng sinh tế bào và khác so với tổn thương xơ hóa động mạch. Tổn thương miệng nối có thể điều trị một tiếp cận đầu tiên với can thiệp nội mạch, dù chúng có thể không phù hợp với nong mạch, và do đó, chúng phù hợp hơn đối với phẫu thuật mở. Lựa chọn điều trị tổn thương xơ hóa động mạch dòng vào dựa vào tiền sử, độc lập của thực tế rằng chúng liên quan với mạch máu cung cấp dòng vào đường vào AV. Theo đó, tổn thương miệng nối dưới đòn thường được điều trị với một phối hợp bóng nong mạch và đặt stent trong nòng mạch với nhiều tổn thương ngoại vi hơn như (động mạch nách, cánh tay, quay, trụ) được điều trị bằng phương pháp nội mạch hoặc phẫu thuật mổ bắc cầu hoặc nong mạch vá mạch (patch angioplasty).
Nong mạch để điều trị hẹp đáng kể trên lâm sàng
Bóng nong mạch áp suất cao

Hình 15.2. Bóng nong áp suất cao tiêu chuẩn (hình ảnh không có trong bản hướng dẫn gốc, người dịch cho thêm vào với ý định để bạn đọc nhận biết rõ hơn)
Hẹp tĩnh mạch do tăng sinh nội mạch tân tạo (Neoendothelial hyperplasia – NH) có đặc điểm dầy đồng tâm và giảm đường kính nòng do tế bào cơ trơn mạch máu tăng sinh [409]. Dù có nhiều cơ chế giả định yếu tố kích thích hình thành NH, bao gồm phản ứng viêm thứ phát sau phẫu thuật tạo AVF, áp lực xé huyết động, chấn thương liên quan đến cắm kim, và có thể là hậu quả trực tiếp của tăng ure máu [410], một giải pháp bền vững với NH hẹp vẫn còn gặp nhiều khó khăn. Tái hẹp ở tổn thương ban đầu hoặc ở đôi khi ở tuần hoàn lọc máu đã điều trị từ trước xảy ra lên đến 60% trong vòng 6 tháng [411]. Ngoài ra, giải pháp nong mạch qua da (PTA) với hẹp đường vào AV là rất cơ học bởi với NH gây tổn thương tiến triển ở bệnh nhân HD [412]. Do hạn chế cơ bản đó ở hiệu quả của PTA tiêu chuẩn, nhiều đổi mới đã được đánh giá trong hướng dẫn này. Ngoài các trường hợp sẽ được mô tả, bóng nong mạch áp suất cao tiêu chuẩn vẫn còn là một lựa chọn cho phần lớn miệng nối và các tổn thương hẹp đường vào AV đáng kể trên lâm sàng. Một tổn thương hẹp đường vào AV đáng kể trên lâm sàng đi kèm các dấu hiệu triệu chứng lâm sàng (tham khảo phần Hướng dẫn 13, Bảng 13.1 và 13.2) và cho thấy thu hẹp trên 50% so với đường kính tĩnh mạch bình thường liền kề qua chụp mạch hoặc siêu âm.
Bóng nong mạch phủ paclitaxel (PCB) trong AVF

Hình 15.3. Bóng nong phủ paclitacel
Một RCT (N=40) so sánh bóng nong phủ paclitaxel so với bóng nong đơn giản để điều trị PTA hẹp đường vào AV (14 AVF và 26 AVG) trong 1 năm [413] (Bảng 15.1).
Huyết khối không khác biệt có ý nghĩa với PCB so với bóng đơn giản (RR, 1.0; 95% CI, 0.16-6.42). Tái hẹp trên chụp mạch thấp hơn có ý nghĩa với PCB so với bóng nong đơn giản (RR, 0.68; 95% CI, 0.49-0.96), nhu cầu thủ thuật nong mạch nhắc lại (RR, 0.63; 95% CI, 0.44-0,92).
Một phân tích tổng hợp thấy rằng stent phủ paclitaxel và bóng nong mạch được sử dụng với bệnh động mạch ngoại vi có liên quan đến tăng tỷ lệ tư vong 5 năm. Một yếu tố nguyên nhân, nếu có, vẫn chưa được xác định rõ liệu phát hiện này đối với bệnh nhân HD và đường vào mạch máu có rõ ràng hay không [416].
Bóng nong mạch cắt
Hai RCT so sánh bóng nong mạch cắt với bóng nong áp suất cao để điều trị hẹp ở AVF [[417, 418]. Một thử nghiệm Canada (N=48; phân tích 39), bao gồm các đối tượng hẹp mới xuất hiện. Một nghiên cứu khác từ Singapore (N=77; phân tích 71) gồm các đối tượng hẹp đã tiến hành bóng nong mạch áp suất cao thất bại được sử dụng ngẫu nhiên PTA bóng cắt so với PTA bóng nong áp suất cao. Tuổi trung bình của AVF xấp xỉ 15 tháng ở thử nghiệm Canada và 22 tháng ở nghiên cứu Singapore [418]. Thành công điều trị trên lâm sàng, được định nghĩa là có khả năng tiến hành lọc máu thành công ít nhất 1 lần sử dụng AVF sau khi nong mạch là 96% và không có khác biệt giữa hai nhóm (RR, 1.00; 95% CI, 0.95-1.05). Thành công điều trị về kỹ thuật, được định nghĩa là còn hẹp dưới 30%, không có khác biệt ở 95% và 98% trong nhóm bóng nong mạch cắt và nhóm bóng nong mạch áp suất cao, tương ứng (RR, 0.98; 95% CI, 0.91-1.05). Toàn bộ, độ thông thoáng 6 tháng không có khác biệt giữa hai nhóm.

Hình 15.4. Bóng nong mạch cắt
Chi tiết nghiên cứu và chất lượng bằng chúng được liệt kê trong Bổ sung 3, Bảng S167.
Thời gian lạm phát bóng nong
Một RCT (N=48) so sánh thời gian lạm phát trong quá trình PTA của hẹp đường vào AV 1 phút so với 3 phút [419]. Hầu hết AVF (88%), với tuổi đường vào AV trung bình là 692 ngày. Có 40 hẹp ở 27 đối tượng lựa chọn vào nhóm 1 phút và 36 hẹp ở 21 đối tượng lựa chọn vào nhóm 3 phút. Kết quả đã được báo cáo lên đến 6 tháng. Điều trị thành công, được định nghĩa là giảm hẹp hơn 30% đường kính nòng hoặc giảm chênh lệch trung bình thấp 10 mmHg ở tổn thương ngoại vị hoặc thấp hơn 5 mmHg ở tổn thương trung tâm, không có khác biệt thống kê giữa các nhóm (75% ở nhóm 1 phút so với 89% ở nhóm 3 phút; P=0.12). Độ thông thoáng chính không có khác biệt giữa các nhóm ở bất kỳ khoảng thời gian sau can thiệp nào (1 tháng, 3 tháng, 6 tháng). Ước tính Kappan-Meier đối với độ thông thoáng 6 tháng là 63% và 47% cho các nhóm có thời gian 1 phút và 3 phút, tương ứng. Một thử nghiệm quan sát (N=75) phân tích dữ liệu thu thập tiến cứu từ cơ sở dữ liệu đường vào mạch máu của hẹp AVG và AVF với 223 lần can thiệp (178 với lạm phát 30 giây và 45 với lạm phát 1 phút [410].
Đặc điểm nhân trắc học và ban đầu là tương tự nhau ở cả hai nhóm. Thành công ngay lập tức của kỹ thuật và độ thông thoáng ở 3 tháng đầu tiên là không có khác biệt (HR, 0.86; 95% CI, 0.34-2.20). Sau 3 tháng, tuy nhiên, thời gian lạm phát 1 phút có liên quan với tỷ lệ mắc hỏng đường vào AV lớn hơn (HR điều chỉnh, 1.74; 95% CI, 1.09-2.79).
Stent để điều trị hẹp đáng kể trên lâm sàng.
Xem Bảng 15.2 cho các chỉ định stent ở đường vào AV.
| Bảng 15.2. Các chỉ định Stent Graft sử dụng trong đường vào AV |
| Vui lòng chú ý rằng chỉ định cho sử dụng stent graft là chỉ trong các kết quả 6 tháng.
Số bệnh nhân có nguy cơ trong các nghiên cứu riêng là quá nhỏ đối với tiêu chí của ERT để xác định các kết quả sau 12 và 24 tháng. Các nghiên cứu không đủ hoặc không có tính nhất quán cho thấy sử dụng Stent graft cải thiện tỷ lệ huyết khối đường vào AV hoặc tỷ lệ sống tích lũy đường vào AV trong phạm vi 6 tháng Các chỉ định dưới đây là phù hợp với các đường vào AV khi không có tắc tĩnh mạch trung tâm. Trước khi sử dụng stent graft, nhà lâm sàng nên cân nhắc trước tiên đến ảnh hưởng của đặt stent graft ở (1) khả năng của đường vào hiện tại với việc cắm kim mà không gây hại và (2) Kế hoạch Sống ESKD của bệnh nhân và phẫu thuật tạo và sử dụng đường vào AV sau này. – Hẹp miệng nối tĩnh mạch graft đáng kể trên lâm sàng hiện tại ở AVG – Huyết khối miệng nối tĩnh mạch graft hiện tại ở AVG – Stent trong stent tái hẹp ở AVF và AVG – Điều trị đoạn hẹp tĩnh mạch bị vỡ ở AVF và AVG – Điều trị phình hoặc giả phình đường vào AV chịn lọc cao (xem phần phình đường vào AV) |
| Chú ý: Kết quả tổng thể 6 tháng tham chiếu với giảm tái hẹp AVG hiện tại ±độ thống thoáng (tổn thương mục tiêu và tuần hoàn đường vào AV. Để đạt được sự đồng thuận trong hướng dẫn, Bảng 15.2 phản ánh quyết định được cân nhắc nhiều của Work Group để tích hợp và cân bằng các bằng chứng hiện có với quan điểm chuyên gia (như, Tuyên bố Hướng dẫn 15.9 đến 15.11), cân nhắc thực hành lâm sàng và nhu cầu lâu dài của bệnh nhân, với số lượng và thời gian theo dõi hạn chế của các bằng chứng sẵn có. Những điểm nhấn này cần được nghiên cứu nghiêm ngặt về sử dụng stent graft ở các đường vào AV, cấn nhắc các phát hiện trên theo dõi và thăm dò lâm sàng cần chỉ định can thiệp và điều trị, và sự cần thiết theo dõi lâu hơn, bao gồm ảnh hưởng của điều trị lên phẫu thuật và sử dụng đường vào AV trong tương lai. |
Stent trong AVG
Hai RCT đánh giá stent graft để điều trị hẹp AVG: Haskal và cộng sự [421] và Vesely và cộng sự [422] so sánh điều trị hẹp miệng nối tĩnh mạch AVG sử dụng nong mạch và stent graft với nong mạch đơn độc. Haskal và cộng sự thực hiện một RCT đa trung tâm (N=190) so sánh nong mạch và đặt stent graft (stent nitinol polytetrafluoroethylene tự mở [Flair Endovascular Stent Graft, Bard Peripheral Vascular]) với nong mạch bóng áp suất cao đơn độc để điều trị hẹp miệng nối tĩnh mạch AVG. Các đối tượng được theo dõi trong 6 tháng. Nhóm điều trị là tương tự nhau ở thời điểm ban đầu, ngoại trừ nhiều miệng nối ở tĩnh mạch nách hơn ở nhóm điều trị nong đơn độc. Huyết khối đường vào được loại trừ, và tiến hành chụp mạch bắt buộc trong 6 tháng. Vesely và cộng sự thực hiện một RCT đa trung tâm (N=293) so sánh nong mạch và tặt stent graft (stent polytetrafluoroethylene tự mở phủ heparin hoạt tính sinh học và cấu trúc nitinol bên ngoài [Viabahn Endoprosthesis With Heparin Bioactive Surface, WL Gore]) với nong mạch đơn độc để điều trị hẹp miệng nối tĩnh mạch AVG [[422]. Các đối tượng được theo dõi trong 24 tháng. Nhóm điều trị là tương tự nhau ở thời điểm ban đầu, ngoại trừ nhiều đối tượng là người Latin ở nhóm nong mạch đơn độc. Huyết khối AVG có trong nghiên cứu, và theo dõi được thực hiện mỗi vị trí tiêu chuẩn thực hành riêng mà không bắt buộc chụp mạch. Kết quả đã được báo cáo cho cả cộng đồng dự định – để – điều trị và cộng đồng theo quy trình; chỉ các kết quả dự định – để – điều trị được trích xuất và phân tích bởi ERT. Do Vesely và cộng sự báo cáo độ thông thoáng chính cho bệnh nhân hẹp so với huyết khối riêng, kết quả đối với bệnh nhân hẹp là cộng gộp với kết quả từ Haskal và cộng sự và được phân tích.
Trong phân tích cộng gộp, độ thông thoáng chính khu vực điều trị (TAPP) bằng nong mạch với đặt sten graft so với nong mạch đơn độc 6 tháng là cao hơn có ý nghĩa ở tổn thương hẹp (RR, 1.71; 95% CI, 1.11-2.64) và ở toàn bộ các tổn thương (hẹp và huyết khối) (RR, 1.50; 95% CI, 1.14-1.97) trong Vesely và cộng sự [422]. Tuy nhiên, trong giai đoạn ngắn hơn, TAPP không có khác biệt có ý nghĩa đối với nong mạch và đặt stent graft so với nong mạch đơn độc ở các tổn thương hẹp trong 2 tháng (RR, 1.04; 95% CI, 0.90-1.21). ACPP bằng nong mạch và stent graft so với nong mạch đơn độc sau 6 tháng cao hơn có ý nghĩa thống kê ở phân tích cộng gộp các tổn thương hẹp (RR, 1.58; 95% CI, 1.30-2.20) và trong nghiên cứu bởi Vesely và cộng sự, ở toàn bộ các tổn thương (hẹp và huyết khối) (RR, 1.46; 95% CI, 1.06-2.01). Tuy nhiên, trong nghiên cứu bởi Haskal và cộng sự, ACPP không khác biệt có ý nghĩa đối với nong mạch và đặt stent graft so với nong mạch đơn độc ở các tổn thương hẹp sau 2 tháng (RR, 1.03; 95% CI, 0.88-1.19).
Bảng các nghiên cứu, chất lượng bằng chứng, và nguy cơ thiên lệch trình bầy trong bổ sung 3, Bảng S168-S177).
Nhiều kết quả ngay lập tức được đánh giá cho thấy rằng nong mạch và đặt stent graft, so với nong mạch đơn độc, có (1) mức độ không can thiệp cao hơn kể từ sau can thiệp (32% nong mạch với stent graft so với 16% nong mạch đơn độc; P=0.03) [421], (2) nguy cơ tái hẹp thấp hơn (RR, 0.52; 95% CI, 0.40-0.68), (3) thời gian trung vị đến khi mất TAPP ở toàn bộ các tổn thương kéo dài hơn (2,013 ngày đối với nong mạch vói stent graft so với 108 ngày đối với nong mạch đơn độc) [423], và (4) thời gian đến khi mất ACPP ở toàn bộ các tổn thương trung vị kéo dài hơn (126 ngày đối với nong mạch với stent graft so với 91 ngày đối với nong mạch đơn độc). Kiểm định cho ý nghĩa thống kê không được báo cáo và không tính trong phân tích thời gian – đến – biến cố.
Haskal và cộng sự [422] không báo cáo các kết quả y tế ngay lập tức. Các tổn hại liên quan với điều trị, bao gồm nhiễm trùng (RR, 2.84; 95% CI, 0.59-13.72), giả phình (RR, 2.37; 95% CI, 0.47- 11.90), và vỡ mạch máu (RR, 2.84; 95% CI, 0.30- 26.82) là không khác biệt có ý nghĩa đối với nong mạch và stent graft so với nong mạch đơn độc trong Haskal và cộng sự. Các biến cố bất lợi trong 30 ngày, lớn (khác biệt nguy cơ, -0.01; 95% CI, -0.03 to 0.005; RR, không xác định) hoặc nhỏ (RR, 2.04; 95% CI, 0.38-10.97) là không có khác biệt có ý nghĩa đối với nong mạch và stent graft so với nong mạch đơn độc trong nghiên cứu Vesely và cộng sự.
Work Group đã thảo luận các nghiên cứu đó và sự ảnh hưởng của chúng. Mối quan tâm tăng lên bao gồm thực tế rằng nghiên cứu của Haskal và cộng sự [[421] sử dụng quy trình chụp mạch để phát hiện tổn thương mà không phải là các tổn thương đáng kể trên lâm sàng; do đó, tính đại diện và mối liên quan với thực hành lâm sàng bị đặt câu hỏi. Không có khác biệt ở huyết khối quan trọng trên lâm sàng. Sau khi nghiên cứu tài liệu và trích xuất dữ liệu bởi ERT, nghiên cứu khác đã được công bố (RENOVA, bởi Haskal và cộng sự), mà được thiết kế tương tự với nghiên của của Haskal trước đó nhưng thời gian theo dõi dài hơn [42.4]. Work Group tổng hợp và cân nhắc nghiên cứu này là tốt. Toàn bộ nghiên cứu báo cáo kết quả 12 tháng và 24 tháng có số bệnh nhân còn nằm trong nguy cơ thấp, loại bỏ sự không chắc chắn trong giải thích (ví dụ, trong nghiên cứu Haskal và cộng sự, ở thời điểm 12 tháng, tổng số bệnh nhân đánh giá ở tình trạng nguy cơ đối với ACPP là 9, và 24 tháng là 0).
Các tuyên bố của Work Group phản ánh cân nhắc của kết quả của 4 nghiên cứu đã công bố và giải thích, ứng dụng, và mối liên quan lâm sàng của chúng rõ ràng trong mối lo lắng của Work Group.
Stent graft trong AVF
Hai nghiên cứu đánh giá stent graft để điều trị hẹp AVF [425, 426]. Shemesh và cộng sự [425] và Rajan và cộng sự [426] so sánh điều trị đối với hẹp vòm tĩnh mạch đầu; Shemesh và cộng sự so sánh nong mạch và stent graft với nong mạch với stent kim loại trần, trong khi Rajan và cộng sự so sánh nong mạch với stent graft với nong mạch đơn độc. ERT không trích xuất dữ liệu từ phân tích của Rajan và cộng sự, do nguy cơ thiên lệch của nghiên cứu cao.
Shemesh và cộng sự (N=25) so sánh 2 nhóm điều trị hẹp vòm tĩnh mạch đầu trong 3 tháng sau PTA thành công từ trước của AVF động mạch cánh tay – tĩnh mạch đầu, với thời gian theo dõi 15 tháng (trung bình, 13.7 tháng) [425]. Stent graft là loại stent nitinol tự mở phủ bằng polytetrafluoroethylene mở rộng (Fluency Plus, Bard Peripheral Vascular, Angiomed GmbH & Co Medizintechnik KG). Stent kim loại trần là loại stent nitinol tự mở (Luminex, Bard Peripheral Vascular, Angiomed GmbH & Co Medizintechnik KG). Stent graft, so sánh với stent kim loại trần cho thấy (1) độ thông thoáng chính cao hơn (HR, 4.09; 95% CI, 1.9-20.3; P = 0.002), (2) không có khác biệt độ thông thoáng phụ (P=0.29 bằng kiểm định log-rank) ở thời điểm 1 năm.
Các can thiệp đối với tái hẹp là ít hơn có ý nghĩa với stent graft so với stent kim loại trần trong toàn bộ quá trình theo dõi (RR, 0.46; 95% CI, 0.22-0.96), cũng như tổng can thiệp mỗi bệnh nhân – năm (RR, 0.47; 95% CI, 0.36- 0.61). Tái hẹp được định nghĩa là hẹp trên 50% sau 3 tháng xác định bằng chụp mạch. Tái hẹp sau 3 tháng là thấp hơn có ý nghĩa với stent graft (RR, 0.26; 95% CI, 0.07-0.97). Chú ý, không tính toán cơ mẫu, và phương pháp toán học cho lựa chọn ngẫu nhiên không được cung cấp. Work Group đã có các thảo luận về các nghiên cứu đó và các quan ngại được chia sẻ về việc tạo ra tuyên bố dựa trên số lượng nhỏ trong các nghiên cứu đó, do đó, làm kiềm chế cho việc ra tuyên bố.
Bảng các nghiên cứu, chất lượng bằng chứng, và nguy cơ thiên lệch trình bầy trong bổ sung 3, Bảng S168-S177).
Stent graft đối với tái hẹp trong stent
Nghiên ngứu tiếp theo được Work Group thảo luận, nhưng không đáp ứng được các tiêu chí trích xuất và tổng hợp bởi ERT do ngày công bố của nó. Một RCT đa trung tâm (N=275) bởi Falk và cộng sự [427] đánh giá hiệu quả của stent graft so với nong mạch đơn độc để điều trị các tổn thương tái hẹp trong stent ở tĩnh mạch dòng ra của tuần hoàn đường vào AV của AVG và AVF [427]. Các điểm cuối chính là ACPP sau 6 tháng và tính an toàn trong 30 ngày; các điểm cuối phụ được đánh giá trong vòng 24 tháng. ACPP sau 6 tháng cao hơn có ý nghĩa ở nhóm stent graft (18.6% so với nhóm nong mạch (4.5%; P<0.001), và không có biến cố về tính an toàn (30 ngày) là có thể so sánh (stent graft, 96.6%; nong mạch, 96.4%; P=0.003 đối với so sánh không thua kém). TAPP là ưu việt hơn với nhóm stent graft (66.4%) so với nhóm nong mạch đơn độc (12.6%) sau 6 tháng (P<0.001). ACPP và TAPP đối với nhóm stent graft chứng minh các kết quả tương tự ở phân nhóm tĩnh mạch trung tâm và ngoại vi (P<0.001). Chú ý, độ thông thoáng toàn bộ hoặc độ thông thoáng phụ không được đánh giá.
Huyết khối – Can thiệp nội mạch hay phẫu thuật
Bất chấp nỗ lực phòng ngừa huyết khối, dự phòng tổn thương hẹp bằng thuốc hoặc nong mạch, huyết khối vẫn thường xảy ra. Cắt huyết khối qua da vẫn còn là một thủ thuật nội mạch phù hợp. Lựa chọn phương pháp phụ thuộc vào kinh nghiệm người thực hành, nguồn lực sẵn có, yếu tố bệnh nhân. Dù thành công ngay lập tức cho ít nhất 1 buổi lọc máu sau thủ thuật có thể đạt được từ 80 đến 95% AVG và AVF đã hình thành huyết khối [428], độ thông thoáng kéo dài sau cắt bỏ huyết khối vẫn khó đạt được, với báo cáo tỷ lệ từ 25% đến 50% sau 6 tháng và 10% đến 20% sau 1 năm [429]. Đối với AVG, một hậu phân tích của 8 RCT so sánh phẫu thuật cắt huyết khối với can thiệp nội mạch đối với AVG hình thành huyết khối và thấy kết quả có thể so sánh được [430]. Về AVF, chỉ các nghiên cứu quan sát điều trị AVF hình thành huyết khối là được xác nhận và chỉ cho thấy kết quả chính là tương đương giữa phẫu thuật và can thiệp nội mạch [431].
Phẫu thuật
Phẫu thuật mở sửa chữa nhìn chung được sử dụng cho các tổn thương gần, cho người không thể tiến hành điều trị nội mạch, và người có kết quả điều trị nội mạch kém [432, 433] Có nhiều kỹ thuật phẫu thuật mở cho các tổn thương tĩnh mạch ngoại vi, bao gồm mảnh ghép xen kẽ và nong mạch vá mạch, với lựa chọn tùy vào mức độ tổn thương. Đáng chú ý, Romann và cộng sự [434] báo cáo thất bại của bóng nong mạch đối với hẹp AVF là tương quan với chiều dài của tổn thương, tỷ lệ thất bại cao nếu trên 2 cm, đề nghị rằng có thể điều trị tốt hơn với phẫu thuật mở. AVF động mạch cánh tay – tĩnh mạch đầu và động mạch cánh tay – tĩnh mạch nền thường thất bại do hình thành hẹp ở vòm tĩnh mạch đầu và “đoạn chia” (tính chất của một bản lề phía gần đối với tĩnh mạch nền chuyển vị). Cả hai tổn thương là có thể tiến hành điều trị nội mạch, nhưng phẫu thuật thay thế có thể phù hợp hơn và vẫn còn là lựa chọn cho các tổn thương hiện tại sau thất bại với điều trị nội mạch. Hai loạt báo cáo với kết quả phẫu thuật có ưu điểm cho hẹp vòm tĩnh mạch nền [435, 436], dù tổng hợp hệ thống đã thất bại trong việc xác nhận tiếp cận ưu tiên ở lựa chọn phẫu thuật mở và can thiệp nội mạch [437].
Thảo luận cụ thể
– Stent và các thay thế có nên sử dụng, điều quan trọng là tránh đặt chúng ở đoạn cắm kim để bảo tồn chức năng và sử dụng đường vào mạch máu
– Toàn bộ, có quá ít nghiên cứu đánh giá liệu pháp để phòng ngừa suy chức năng AVF và AVG mà có chất lượng bằng chứng cao.
– Xem bình luận ở phần giải thích chi tiết đối với thảo luận của Work Group về sử dụng stent graft.
Các cân nhắc thực hiện
– Theo dõi chặt chẽ và ghi chép hiệu quả của việc sử dụng stent graft trên kết quả theo dõi lâu dài đối với ảnh hưởng hiện tại và tương lai đường vào AV.
Theo dõi và đánh giá
– Do một số các liệu pháp đó đã được tiến hành ở các nghiên cuus nhỏ và thường không ngẫu nhiên, các biến cố bất lợi cần theo dõi và đánh giá chặt chẽ.
Các nghiên cứu trong tương lai
– Nghiên cứu kết quả bệnh nhân và đường vào AV và ảnh hưởng của (1) nong mạch dưới hướng dẫn của siêu âm và (2) nhông mạch dưới hướng dẫn của siêu mâm trong nòng mạch, để hạn chế phơi nhiễm chất cản quang ở bệnh nhân CKD/ESKD còn chức năng thận tồn dư và còn đi tiểu được.
– Stent graft so với stent kim loại trần để điều trị hẹp tĩnh mạch trung tâm yêu cầu đánh giá RCT nhiều hơn, với số lượng bệnh nhân lớn hơn, thực hiện nghiêm ngặt, và phân tích.
– Nhiều RCT đánh giá stent graft cho quản lý đường vào mạch máu (nguyên phát và thứ phát) với các kết quả dựa vào lâm sàng (hơn là dựa vào chụp mạch) là một yêu cầu cấp bách.
– Nghiên cứu sự cần thiết AVF đối với đa phương thức điều trị (như, stent graft, bóng nong rửa thuốc, …).
– So sánh phương pháp tiêu huyết khối đường vào AV (phẫu thuật so với nội mạch) với nhiều kết quả AVF và AVG thời gian ngắn và lâu dài.
– Tăng chất lượng bằng chứng trong lĩnh vực:
+ Sử dụng bóng nong đặc biệt (phủ thuốc hoặc cắt) so với bóng nong áp suất cao trong điều trị hẹp AVF và AVG chính.
+ Thời gian tối ưu của thời gian lạm phát bóng nong trong quá trình nong mạch để tối ưu độ thông thoáng chính trong điều trị hẹp AVF và AVG
+ Sử dụng thứ phát bóng nong phủ thuốc sau nong mạch thành công với bóng nong áp suất cao để điều trị hẹp AVF và AVG.
– Ảnh hưởng của tái hẹp lại trên lựa chọn phương thức điều trị.
– Sử dụng stent graft ở vị trí khác ngoài miệng nối tĩnh mạch của graft hoặc vòm tĩnh mạch đầu trong AVF động mạch cánh tay – tĩnh mạch đầu.
– Điều trị tối ưu của hẹp trong stent.
– Nghiên cứu kết quả của phẫu thuật điều chỉnh đường vào AV đã tắc mà theo dõi bằng sơ đồ mạch hoặc chụp hình ảnh mạch ±thủ thuật thêm. Chiến lược này làm như thế nào so với phẫu thuật điều chỉnh trong tiền sử mà không quản lý bằng hình ảnh hoặc nội mạch?
– Thời điểm tối ưu của nong mạch/lấy huyết khối hoặc cắt huyết khoos trong AVF và AVG đã hình thành huyết khối.
– Nghiên cuus để xác định thông số đo tốt nhất mà định nghĩa kết quả thủ thuật thành công: ví dụ, nên là phân trăm tương đối cải thiện kích thước nòng mạng trong hoặc đường kính nòng tuyệt đối hoặc thông số đo khác không? Khi nào nên đo sau điều trị (như PTA) (trong hay sau thủ thuật?).
Tuyên bố: Điều trị huyết khối đường vào AV
15.13. KDOQI cân nhắc điều hợp lý rằng quản lý mỗi lần huyết khối đường vào AV là ở đánh giá và quyết định tốt nhất của nhà lâm sàng hoặc người thực hành, và liên quan đến những cân nhắc của Kế hoạch Thành công đường vào lọc máu của bệnh nhân nhất quán với Kế hoạch Sống ESKD, khi đường vào AV bị tổn hạy sau điều trị can thiệp nội mạch hoặc phẫu thuật. (Quan điểm chuyên gia)
Chú ý: Quyết định của nhà lâm sàng hoặc người thực hành cân nhắc cẩn thận cả các trường hợp riêng của bệnh nhân và kinh nghiệm và mức độ chuyên môn lâm sàng của nhà lâm sàng hoặc người thực hành (năng lực và hạn chế). Kế hoạch Thành công là một thành phần của P-L-A-N (xem Theo dõi và đánh giá thảo luận ở Hướng dẫn 1).
15.14. KDOQI cân nhắc điều hợp lý với việc điều trị phẫu thuật một hỏng đường vào AV ở những trường hợp sau: (1) thất bại điều trị can thiệp nội mạch, (2) tổn thương lâm sàng không phù hợp để can thiệp nội mạch, (3) tình huống mà kết quả phẫu thuật được cho là tốt hơn rõ ràng. (Quan điểm chuyên gia)
Chú ý: Tình huống khi mà kết quả phẫu thuật là phù hợp để trở thành một lựa chọn thay thế tốt hơn nên được thảo luận trước và được sự đồng ý của đội quản lý đường vào mạch máu của bệnh nhân, bao gồm nhưng không hạn chế, bệnh nhân vời một hay nhiều người sau: bác sỹ thận niệu, bá sỹ can thiệp, bác sỹ phẫu thuật, người hợp tác đường vào mạch máu, và chuyên gia cắm kim, nếu có thể.
Giải thích/Tổng quan
Huyết khối tắc toàn bộ đại diện cho một biến cố cuối cùng đối với hỏng đường vào AV và chiếm khoảng 65% đến 85% nguyên nhân bỏ đường vào AV [348]. Dù nguyên nhân đong gips của biến cố huyết khối cuối cùng thường có thể quan sát thấy (như lưu lượng máu thấp liên quan đến hẹp dòng ra của tĩnh mạch trong AVG), bệnh nhân có thể hình thành huyết khối mới mà không có cơ chế rõ ràng [439]. Ưu tiên lâm sàng bao gồm cung cấp lọc máu hiệu quả, làm sạch huyết khối tỏng nòng mạch, và điều trị nguyên nhân.
Chẩn đoán đường vào AV bị huyết khối thường trực quan trên khám lâm sàng nhưng cần được xác nhận bằng siêu âm Duplex. Bệnh nhân với nhu cầu lọc máu cấp thiết (như quá tải thể tích, tăng kali máu) nên được lọc máu qua một CVC tạm thời không cuff trước khi điều trị huyết khối đường vào AV.
Giải thích chi tiết
Cả phương pháp nội mạch và phẫu thuật mở để điều trị huyết khối AVG đều được chấp nhận, vói lựa chọn được xác định bởi kinh nghiệm và thực hành của địa phương, dưới điều kiện cụ thể, và sự ưu tiên của bệnh nhân. Dù các bó cáo sớm đề nghị các kết quả ưu tiên với phương pháp phẫu thuật, các báo cáo gần đầy để nghỉ cả hai phương pháp đối với AVG là có thể chấp nhận, phản ánh tiến bộ trong các liệu trình nội mạch [431, 440, 441]. Thêm nữa, có một số phương pháp nội mạch khác, dù không có tính ưu việt [438]. Điều quan trọng, phương pháp phẫu thuật mở và can thiệp nội mạch không nên coi là một phương pháp toàn điện, bởi có những phương pháp kết hợp cả hai (như phẫu thuật cắt huyết khối phối hợp với bóng nong mạch trong hẹp tĩnh mạch trung tâm) [442, 443]. Sự tiến bộ dần dần tỏng tiếp cận điều trị huyết khối AVF mà phiên bản Hướng dẫn KDQOI 2006 trước đây khuyến cáo bỏ AVF đến nỗ lực hơn nữa là cắt huyết khối AVF và bảo tồn đường vào AV [395, 444]. Một phân tích tổng hợp bởi Kuhan và cộng sư [441] nhấn mạnh thiếu dữ liệu đủ lâu dài với chất lượng bằng chứng thấp để hướng dẫn quản lý huyết khối AVF. Chống chỉ định cắt huyết khối đường vào AV bao gồm tăng áp lực động mạch phổi và shunt phải trái trong tim do nguy cơ tắc khí và nhiễm trùng đường vào AV.
Bất kể tiếp cận nào, cắt huyết khối nên được tiến hành trong một khỏng thời gian sau biến cố, đặc biệt với AVF, khi đưa vào cơ chế bệnh sinh của quá trình hình thành huyết khối và dưới điều kiện đáp ứng viêm. Dù có thể loại bỏ huyết khối AVG lên đến 30 ngày, cắt huyết khối sớm có liên quan đến kết quả lâu dài tốt hơn [445]. Sadaghialoo và cộng sự [446] báo cáo cắt huyết khối trong vòng 6 fiowf có liên quan với kết quả kỹ thuật tốt hơn và kết quả giai đoạn trung bình được cải thiện. Về tính thực hành, cắt huyết khối sớm giúp giảm thiểu và/hoặc loại bỏ nhu cầu lọc máu qua CVC. Tuy nhiên, bệnh nhân có thể vẫn cần một CVC để lọc máu để quản lý quá tải thể tích hoặc bất thường điện giải trươc skhi tiến hành cắt huyết khối.
Dù tỷ lệ thành công về mặt kỹ thuật đối với cắt huyết khối, cả nội mạch và phẫu thuật, là tốt, tỷ lệ độ thông thoáng lâu dài là kém, nằm dưới điểm tiêu chí quan trong của lựa chọn đường vào AV tiếp theo (như kế hoạch thành công đường vào AV) ngay cả trước mỗi một biến cố huyết khối [438, 447, 448]. Simoni và cộng sự [449] báo cáo từ một hệ thống đăng ký thiết bị lớn với tỷ lệ thành công về kỹ thuật của AngioJet (Boston Scientific, Marlborough, MA) thiết bị cắt huyết khối qua da là 92%, dù tỷ lệ độ thông thoáng cho AVG và AVG là 53% và 86%, tương ứng, sau 3 tháng. Tương tự, Quencer and Friedman [438] tổng hợp tỷ lệ độ thông thoáng sau cắt huyết khối tỏng khoảng 25% đến 50% sau 6 tháng và 10% đến 20% sau 12 tháng cho cả AVG và AVF. Theo đó, cắt huyết khối nhắc lại ở cùng đường vào AV có lẽ là không hợp lý.
Điều trị xác định yêu cầu nhận biết và điều chỉnh nguyên nhân của huyết khối đường vào AV. Chẩn đoán hình ảnh toàn bộ nên được làm sau khi cắt huyết khổi qua nội mạch hoặc phẫu thuật để xác nhận tôn thương gây ra được điều chỉnh.
Huyết khối đường vào AV trong một khoảng thời gian sau phẫu thuật (dưới 30 ngày) là thường do vấn đề kỹ thuật (như hẹp miệng nối) hoặc lựa chọn động tĩnh mạch không đầy đủ (như tĩnh mạch nhỏ) đối với một AVF. Cắt huyết khối đường vào AV và/hoặc khắc phục là có thể nếu nhận biết được các vấn đề kỹ thauatj, dù điều trị nguyên nhân thường yêu cầu tiến hành tạo một đường vào AV mới. Tiêu huyết khối thường liên quan đến chống chỉ định trong giai đoạn sớm sau phẫu thauatj do liên quan đến nguy cơ chảy máu.
Những cân nhắc thực hiện
Toàn bộ loại và cấu hình đường vào mạch máu HD có thời gian sống hạn chế và, theo đó, cuối cùng sẽ hỏng hoàn toàn hoặc không thể bắt đầu lọc máu được (đường vào hỏng). Đây là mối quan tâm của nhiều nhà cung cấp dịch vụ y tế trong lĩnh vực chăm sóc bệnh nhân lọc máu cần phải công nhận suy chức năng đường vào và quan tâm đến nhiều mô hình hỏng đường vào mạch máu (các biến chứng của đường vào AV). Rosenberg và cộn sự [450] báo cáo rằng có thể đào tạo cho những chuyên gia không hoạt động trong lĩnh vực y tế đủ kỹ năng khám lâm sàng nhận biết hỏng đường vào trong một khoảng thời gian ngắn. Hơn nữa, một điều qun trọng là chính bản thân bệnh nhân chịu trách nhiệm chăm sóc và duy trì đường vào mạch máu. Những mục đích là lọc máu an toàn và hiệu quả với ít nhu cầu can thiệp, có hiệu quả chi phí. Bất kỳ can thiệp nào nên cân nhắc awnhr hưởng lên đường vào mạch máu hiện tại và tương lai; ví dụ, những đoạn cắm kim hiệu quả nên tránh khi đặt stent graft. Hy vọng rằng nhận biết và xác định điều trị sớm của hỏng và huyết khối đường vào mạch máu sẽ làm cải thiện tỷ lệ sống chức năng đường vào mạch máu.
Theo dõi và đánh giá
Nhận biết hỏng và huyết khối đường vào AV nên là một phần của quy trình theo dõi thường cuyên (Hướng dẫn 11.1 và 13). Đây là một điều quan trọng cho nhiều nhà cung cấp dịch vụ y tế mà học có thể giới hiệu hoặc tiến hành điều trị phù hợp, như một phần của kế hoạch liên tục đường vào mạch máu. Ở thời điểm đó, cân nhắc và kế hoạch cho đường vào lọc máu tiếp theo hoặc phương thức điều trị thay thế thận tiếp theo (khi phù hợp) nên bắt đầu theo chiến lược Kế hoạch Sống ESKD của từng bệnh nhân.
Nghiên cứu trong lai.
– Định nghĩa và xác thực các chiến lược theo dõi tối ưu đối với suy chức năng đường vào AV.
– Định nghĩa và xác thực ngưỡng can thiệp đối với suy chức năng đường vào AV
– Định nghĩa điều trị phẫu thuật mở và nội mạch đối với suy chức năng và huyết khối đường vào AV.
– Định nghĩa các chỉ số kết quả suy chức năng và huyết khối đường vào AV.
– Xác định kết quả với phẫu thuật điều chỉnh tắc đường vào AV mà tiếp theo bằng chẩn đoán hình ảnh mạch máu hoặc sơ đồ mạch máu ± quy tình điều chỉnh theme/ Chiến lược này so sánh với phẫu thuật điều chỉnh trong quá khứ mà không chẩn đoán hình ảnh hoặc can thiệp nội mạch như thế nào?
| Hướng dẫn 14 | Trở lại mục lục | Hướng dẫn 16 |