CHƯƠNG 4: TRUYỀN HỒNG CẦU ĐỂ ĐIỀU TRỊ THIẾU MÁU TRONG CKD
KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease – August (2), 2012
Dịch: BSCKI Nguyễn Thanh Hùng – PTTK Hội Lọc máu Việt Nam
TRUYỀN HỒNG CẦU TRONG THIẾU MÁU MẠN
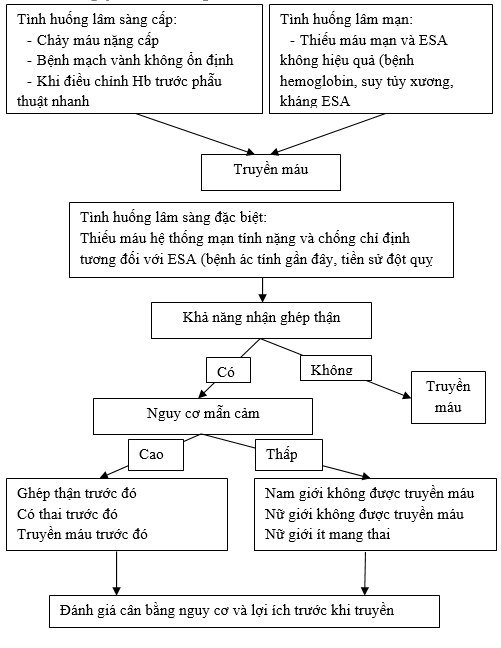
Truyền hồng cầu nhiều lần hoặc sử dụng thuốc kích thích sinh hồng cầu (ESA) là hai lựu chọn điều trị đối với thiếu máu mạn trong CKD. Lựa chọn giữa hai phương pháp điều trị phụ thuộc vào tính tương đối của lợi ích và tổn hại, mà thay đổi giữa các bệnh nhân. Ví dụ, các bệnh nhân với tiền sử đột quỵ có nguy cơ tuyệt đối của đột quỵ liên quan đến ESA lớn nhất127, trong khi phụ nữ nhiều lần sinh có nguy cơ cao nhất của tự mẫn cảm với truyền máu190,101. Dù tầm quan trọng lâm sàng của tự mẫn cảm vẫn được tranh luận, nó có thể gây ra sự trì hoãn hoặc giảm khả năng ghép thận trong tương lai.
|
4.1.1. Khi quản lý thiếu máu mạn, chúng tôi khuyến cáo tránh, khi có thể, truyền hồng cầu để giảm thiểu nguy cơ chung liên quan đến sử dụng hồng cầu (1B) 4.1.2. Ở các bệnh nhân đã có đủ điều kiện ghép tạng, chúng tôi đặc biệt khuyến cáo tránh, khi có thể, truyền hồng cầu để giảm thiểu nguy cơ thải bỏ tạng ghép (1C) 4.1.3. Khi quản lý thiếu máu mạn, chúng tôi đề nghị rằng lợi ích của truyền hồng cầu có thể cân đối với các nguy cơ ở các bệnh nhân mà (2C): – Điều trị ESA là không hiệu quả (như bệnh lý hồng cầu, suy tủy xương, kháng ESA) – Các nguy cơ của điều trị ESA có thể cần đối với lợi ích của chính nó (như bệnh ác tính trước hoặc mới gần đây, tiền sử đột quỵ) 4.1.4. Chúng tôi đề nghị rằng quyết định truyền một bệnh nhân CKD không có thiếu máu cấp không nên dựa vào bất kỳ ngưỡng hemoglobin cố định nào, nhưng nên xác định bởi các triệu chứng do thiếu máu xảy ra. |
GIẢI THÍCH
Giống như với bất kỳ điều trị nào, truyền hồng cầu nên được xem xét trong điều kiện cân bằng các lợi ích với các tổn hại. Lợi ích chính là khả năng mang oxy đủ và cải thiện các triệu chứng liên quan đến thiếu máu192. Các tổn hại được tổng hợp trong Bảng 5 và 6 và được thảo luận sâu hơn ở phần dưới. Cân bằng này phải được cân nhắc bên cạnh cân bằng của các lợi ích và tổn hại của điều trị ESA, một điều trị thay thế cho thiếu máu của CKD. Các lợi ích và tổn hại của điều trị ESA đã được thảo luận chi tiết trong Chương 3, nhưng, trong sự tổng hợp, các lợi ích bao gồm cải thiện các triệu chứng liên quan đến thiếu máu và giảm sự cần thiết của truyền máu, và các tổn hại chủ yếu bao gồm tăng nguy cơ đột quỵ, huyết khối, và tiến triển hoặc tái phát ung thư. Khi lựa chọn giữa hai điều trị đó đối với thiếu máu ở một đặc tính bệnh nhân riêng mà thường xuyên phải cân bằng giữa nguy cơ và lợi ích cho mỗi điều trị nên được cân nhắc. Các vấn đề đó bao gồm tiền sử đột quỵ và ung thư trước đó hoặc hiện có mà đặt bệnh nhân điều trị ESA ở nguy cơ tuyệt đối cao hơn của hai vấn đề đó. Ngược lại, các bệnh nhân đã đủ điều kiện cho ghép thận có tổn hại lớn nhất từ truyền máu, trong điều kiện của tự mẫn cảm190,193,194, dù tầm quan trọng lâm sàng của tự mẫn cảm được tranh cãi. Bệnh nhân ghép tạng trước đó và phụ nữ sinh đẻ nhiều lần dường như có nguy cơ tuyệt đối lớn nhất của tự mẫn cảm190,191.
Một vấn đề liên quan là quyết định điều trị một bệnh nhân bằng ESA hay truyền máu được tạo ra khi nào? Quyết định này là khác nhau một cách tinh tế đối với hai loại điều trị vì ESA có thể được sử dụng để tránh truyền máu và do đó trước khi phát sinh nhu cầu truyền máu, tức là theo nghĩa dự phòng. Hơn nữa, mức độ lớn của các tổn hại có khả năng xảy ra của truyền máu (như nhiễm trùng) và một số lợi ích từ ESA (như tránh truyền máu) là phụ thuộc trên ngưỡng để ra y lệnh truyền máu. Nếu ngưỡng đó là cao (truyền máu được để dành đến khi các triệu chúng trở lên nặng hoặc hemoglobin đến mức rất thấp) hoặc các nguy cơ liên quan đến truyền máu sẽ là thấp và lợi ích của điều trị ESA trong việc tránh truyền máu sẽ nhỏ. Không may, không có sự đồng thuận về việc khi nào truyền máu được chỉ định dù chúng tôi biết rằng tỷ lệ truyền máu tăng rõ ràng khi hemoglobin giảm xuống dưới 100 g/l122,127. Liệu rằng phản ánh đơn giản các hình thái thực hành hoặc xuất hiện lâm sàng rõ ràng cần thiết là chưa sáng tỏ hay không. Các thử nghiệm sau đem đến các ví dụ tỷ lệ truyền máu ở các bệnh nhân CKD 5D và CKD ND. Thử nghiệm đã kết luận bởi Canadian Erythropoietin Study Group, công bố vào năm 1990, gồm 118 bệnh nhân CKD 5HD hemoglobin < 90 g/l, 49 (42%) bệnh nhân đã được mô tả là “phụ thuộc truyền máu”122. Các bệnh nhân có xấp xỉ trung bình 7 lần truyền máu trong 12 tháng trước nghiên cứu. Các bệnh nhân đó được chọn ngẫu nhiên, bằng nhau, với 6 tháng điều trị với giả dược, erythropoietin với mục tiêu hemoglobin 95-110 g/l, hoặc vào nhóm erythropoietin với mục tiêu hemoglobin 115 đến 130 g/l. Sau 8 tuần, 23 bệnh nhân trong nhóm giả dược đã được truyền máu, so sánh với 1 bệnh nhân trong hai nhóm erythropoietin (một do xuất huyết tiêu hóa và một do phẫu thuật). Gần đây hơn, trong Trial to Reduce Cardiovascular Events with Aranesp Therapy (TREAT), công bố năm 2009, 4038 bệnh nhân đái tháo đường, CKD ND và thiếu máu (hemoglobin ≤110 g/l), được chọn ngẫu nhiên, cân bằng, điều trị i darbepoetin alfa với mục tiêu 130 g/l hoặc với giả dược, tái điều trị darbepoetin khi hemoglobin xuống dưới 90 g/l127. Thời gian theo dõi trung bình 29 tháng, 297/2012 (15%) bệnh nhân ngẫu nhiên trong nhóm darbepoetin alfa và 496/2026 (25%) được trong nhóm giả dược cần truyền hồng cầu (HR 0.56, 95% CI 0.49-0.65, P<0.001).
Chúng tôi đề nghị rằng quyết định để truyền máu ở các bệnh nhân thiếu máu không cấp tính liên quan CKD không nên dựa trên bất kỳ ngưỡng hemoglobin cụ thể nào và nên, thay thế, được xác định bằng sự xuất hiện của triệu chứng và dấu hiệu do thiếu máu. Chúng tôi công nhận rằng các triệu chứng như khó thở và mệt mỏi là không đặc hiệu, và rằng các triệu chứng liên quan đến thiếu máu có thể xảy ra ở các mức độ hemoglobin khác nhau ở các bệnh nhân khác nhau.
Các nguy cơ của truyền máu
Các nguy cơ của truyền máu bao gồm sai sót truyền máu, quá tải thể tích, tăng kali máu, ngộ độc citrate (dẫn đến kiềm chuyển hóa và hạ kali máu), hạ thân nhiệt, bệnh đông máu, các phản ứng truyền máu trung gian miễn dịch, bao gồm tổn thương phổi cấp liên quan đến truyền máu (TRALI), và quá tải sắt, toàn bộ nguy cơ là không phổ biến (Bảng 5)190,195-207. Nhiễm trùng truyền qua máu, dù hiếm, là một mối quan ngại chính và thay đổi giữa các quốc gia (Bảng 6)208-211. Các biến chứng đó đã được nghiên cứu rộng rãi ở các nơi khác nhau. Tầm quan trọng của mẫn cảm kháng nguyên bạch cầu người được tranh luận và thảo luận chi tiết ở dưới.
| Bảng 5: ước tính nguy cơ liên quan đến truyền máu mỗi đơn vị truyền | ||
| Biến cố bất lợi | Ước tính nguy cơ* | |
| Miễn dịch | Phản ứng sốt/dị ứng | 1 trong 100-200a,b |
| Phản ứng tan máu | 1 trong 6000b | |
| Tổn thương phổi cấp liên quan đến truyền máu | 1 trong 12.350a | |
| Phản vệ | 1 trong 50.000b | |
| Tan máu tử vong | 1 trong 1.250.000a | |
| Bệnh vật chủ – mảnh ghép (GVHD) | Hiếm | |
| Khác | Mất truyền máu | 1 trong 14.000-19.000c |
| *: Dữ liều Hoa Kỳ; a: Dữ liệu từ Carson JL và cộng sự212; b: Dữ liệu từ Klein213; c: Dữ liệu từ Klein HG và cộng sự214 | ||
| Bảng 6: Ước tính nguy cơ lây nhiễm qua truyền máu mỗi đơn vị truyền | |
| Nguy cơ liên quan đến truyền máu | Ước tính nguy cơ* |
| Viêm gan B | 1 trong 282.000 đến 1 trong 375000a |
| Virus West Nile | 1 trong 350.000b |
| Nhiễm trùng nặng tử vong | 1 trong 1.000.000b |
| Viêm gan C | 1 trong 1.149.000a |
| HIV | 1 trong 1.267.000a |
| *: Dữ liệu từ Hoa Kỳ; a: Dữ liệu từ Carson JL và cộng sự212; b: Dữ liệu từ Rawn J215 | |
Mẫn cảm kháng nguyên bạch cầu người (HLA): Nguy cơ mẫn cảm sau truyền máu đã thay đổi theo thời gian, ít nhất là từng phần, do thay đổi trong thực hành truyền máu và sử dụng phương pháp kỹ càng hơn để xác định tự mẫn cảm.
Trong những năm đầu của những năm 1980, Opelz và cộng sự đã kiểm chứng nguy cơ mẫn cảm trong 737 bệnh nhân CKD 5HD (Hình 3A và 3B), của 331 người thực hiện nghiên cứu tiến cứu (Hình 3C)190. Xấp xỉ 90% toàn bộ lần truyền máu trong dạng ‘đóng túi’ và kháng thể được xét nghiệm bằng xét nghiệm độc tế bào lympho. Toàn bộ, 28% bệnh nhân thực hiện tiến cứu đã hình thành kháng thể HLA. Trong đó, 18% hình thành phản ứng đến 10-50% của panel, 7% đến 50-90% và <3% lên đến >90% của các panel sau khi số lần truyền lên đến 20 lần (Hình 3C). Ở nam giới, 90% vẫn còn ‘không đáp ứng’ (<10% phản ứng kháng thể kháng panel) và 10% phản ứng đến 10-50% của panel (hình 3C). Tương phản, sau 10 lần truyền, chỉ 60% ở phụ nữ là ‘không đáp ứng’, 11% đã chứng minh 10-50% phản ứng, 23% có 51-90% phản ứng, và 6% có >90% phản ứng (Hình 3C). Dữ liệu đó đề nghị rằng nguy cơ chính của mẫn cảm HLA sau truyền hồng cầu là mang thai từ trước và ghép tạng từ trước. Dữ liệu đề nghị rằng nam giới có nguy cơ mẫn cảm HLA thấp hơn phụ nữ, và phụ nữ nhiều lần mang thai có nguy cơ mẫn cảm HLA cao hơn phụ nữ mang thai ít lần. Tuy nhiên, dữ liệu gần đây hơn từ US Renal Data System (USRDS) 2010 Annual Report,191 đã thách thức tổng hợp này, đề nghị rằng nam giới được truyền máu trước đó chỉ ở tình trạng tăng nguy cơ.
Các nghiên cứu đã tiến hành trong hai thập kỷ qua đã cho thấy rằng nguy cơ mẫn cảm với truyền máu là thấp hơn dữ liệu đã báo cáo trước đây, với tỷ lệ đáp ứng toàn bộ trong khoảng 2 đến 21%216-218. Một khả năng, mặc dù gây tranh cãi về việc giải thích cho mẫn cảm thấp hơn này là truyền hồng cầu trong những năm gần đây ít tạo miễn dịch hơn bởi chứa ít bạch cầu do sử dụng rộng rãi kỹ thuật lọc tế bào máu.
Các kết luận từ các nghiên cứu trước bao gồm các vấn đề sau: a) hồng cầu rửa không cho thấy ít tính miễn dịch hơn hồng cầu không được rửa190; b) giảm không nhất quán trong mẫn cảm đã được chứng minh với tính đặc hiệu người hiến217 và truyền máu đã phù hợp HLA-DR219; c) số lượng cao hơn của truyền máu có liên quan đến tăng nguy cơ mẫn cảm ở một số nghiên cứu220,221 nhưng không thấy trong nghiên cứu khác.
Tuy nhiên, dữ liệu từ USRDS chỉ ra rằng nguy cơ mẫn cảm với truyền máu là đáng kể. Ví dụ, so sánh với các bệnh nhân không bao giờ truyền máu, các bệnh nhân đã truyền máu có OR của panel phản ứng kháng thể (PRA) > 80% là 2.38191. Điều thú vị, trong phân tích này nguy cơ nhạy cao ở thời điểm ghép là cao hơn đối với nam giới so với nữ giới.
Hiệu quả giảm bạch cầu mẫn cảm của truyền máu : Dù, bạch cầu có thể góp phần với, nó không phải là nguyên nhân của, một số các hậu quả bất lợi của truyền máu, bao gồm ảnh hưởng trung gian miễn dịch, lây truyền bệnh nhiễm trùng, và tổn thương tái tưới máu, giảm bạch cầu của chế phẩm máu không làm giảm mẫn cảm trong truyền máu trước hoặc khả năng ghép thận trong tương lai223-225.
Một nghiên cứu gần đây đã báo cáo nam giới đang đợi lần ghép đầu tiên tăng nguy cơ 4 lần cho hình thành kháng thể HLA nếu họ có truyền máu trước đó khi so sánh với người không có tiền sử truyền máu226. Do đó, truyền máu sau khi lấy bạch cầu vẫn còn đặt ra một nguy cơ đáng kể của mẫn cảm. Lý do có thể cho phát hiện này là số lượng của phân tử HLA có trên hồng cầu góp phần như so sánh với bạch cầu227.
Hình 3: Phản ứng kháng thể độc tế bào bạch cầu kháng xét nghiệm panel người hiến ngẫu nhiên với số lần truyền máu. Phần bệnh nhân phản ứng chống lại < 10%, 10-50%, 51 đến 90% và >90% của panel người hiến được vẽ. Toàn bộ 737 bệnh nhan chạy thận nhân tạo, chờ ghéo thận lần đầu. Số bệnh nhân sau 2, 5, 10, và 20 lần truyển máu được chỉ ra ở biểu đồ trên cùng. (A) Nam giới và nữ giới. (B) Bệnh nhân nữ giới được chia ra bằng số lần có thai. (C) kháng thể độc tế bào bạch cầu ở các bệnh nhân được nghiên cứu tiến cứu qua thời gian điều trị. Reprinted from Opelz G, Graver B, Mickey MR et al. Lymphocytotoxic antibody responses to transfusions in potential kidney transplant recipients. Transplantation 1981; 32(3): 177–183 (ref. 190) with permission from Lippincott Williams & Wilkins; accessed http://journals.lww.com/transplantjournal/Abstract/1981/09000/. Lymphocytoxic_Antibody_Responses_to_Transfusions.2.aspx
Liên quan giữa mẫn cảm và trì hoãn ghép tạng: Theo dữ liệu USRDS đã báo cáo trong năm 2010, thời gian chờ đợi ghép thận cho các bệnh nhân giữa năm 1991 đến 2008 là trung bình dài hơn 2 tháng đối với người đã được truyền máu so với người không truyền máu ở Hoa Kỳ191. Tăng hiệu giá PRA, liệu do truyền máu hay các yếu tố khác, có liên quan với thời gian chờ đợi để tìm người hiến thích hợp và có thể ngăn cản hoàn toàn việc ghép thận ở một số bệnh nhân. Các bệnh nhân không nhạy (0% PRA ở thời điểm được liệt kê) có thời gian chờ ngắn hơn (trung bình 2.5 năm trong năm 2005) trong khi người với PRA 1-19% và 20-79% có thời gian chờ trung bình là 2.9 và 4.3 năm, tương ứng. Các bệnh nhân nhạy cảm cao (≥80% PRA) đợi lâu nhất và trong các bệnh nhân đó, một thời gian chờ có thể không được tính đối với danh sách bệnh nhân trong năm 2005. Như một hậu quả của làm chậm trong tìm kiếm người hiến ở các bệnh nhân có PRA ≥ 80%, tỷ lệ phần trăm các bệnh nhân đó tăng 7.5% ở thời điểm liệt kê đến 13.3% sau liệt kê 5 năm.
Không được ghép, hoặc có thời gian chờ ghép lâu hơn, có liên quan đến tỷ lệ sống thấp hơn228,229. Nhận được một lần truyền máu trên danh sách chờ ghép có liên quan đến nguy cơ tử vong cao hơn gấp 5 lần trong khi ở danh sách chờ trong 5 năm đầu tiên, và 11% giảm trong khả năng nhận ghép trong 5 năm đầu tiên191,230. Ở các bệnh nhân đã ghép, sự xuất hiện của kháng thể HLA có liên quan đến tăng nguy cơ mất tạng ghép sớm và muộn193,194,231,232. Dữ liệu gần đây đề nghị rằng kháng thể HLA đặc hiệu người hiến tồn tại từ trước xác định bằng xét nghiệm kháng nguyên Luminex đơn ở thời điểm ghép có liên quan với tỷ lệ phát sinh đào thải do kháng thể trung gian cao hơn và tỷ lệ sống tạng ghép thấp hơn233.
TRUYỀN MÁU CẤP CỨU CỦA THIẾU MÁU
|
4.2. Trong phần lớn các tình huống lâm sàng cấp tính, chúng tôi đề nghị bệnh nhân được truyền hồng cầu khi lợi ích của truyền hồng cầu cân bằng các nguy cơ; chúng bao gồm (2C): – Khi yêu cầu điều chỉnh thiếu máu nhanh để ổn định các điều kiện của bệnh nhân (như tan máu, bệnh mạch vành không ổn đinh) – Khi điều chỉnh hemoglobin nhanh chóng trước khi yêu cầu phẫu thuật. |
GIẢI THÍCH
Trong phần lớn các tình huống lâm sàng cấp cứu, truyền hồng cầu có thể cần thiết cho điều chỉnh ngay lập tức thiếu máu. Các tình huống đó bao gồm chảy máu cấp cứu nặng và các vấn đề thiếu máu lâm sàng khác như thiếu máu cơ tim cấp. Khi phẫu thuật cấp cứu được yêu cầu, truyền máu chỉ có thể được đưa ra để đạt được điều chỉnh Hb nhanh. Ngưỡng hemoglobin cho truyền máu trong tình huống này là không rõ ràng nhưng chúng tôi đề nghị điều trị này được cân nhắc nếu hemoglobin < 70g/l.
Bảng 7 và Hình 4 tổng hợp các tiếp cận sử dụng của truyền máu như là một can thiệp ban đầu ở các bệnh nhân thiếu máu và CKD.
| Bảng 7: Chỉ định truyền máu | |
| Chỉ định | Bình luận |
| Khi điều chỉnh nhanh thiếu máu được yêu cầu để ổn định các điều kiện bệnh nhân (như chảy máu cấp tính, thiếu máu cơ tim không ổn định) | – Truyền hồng cầu ở các bệnh nhân chảy máu cấp được chỉ định trong các tình huống sau: a) Chẩy máu cấp không kiểm soát được tình trạng chảy máu ngay; b)ước tính mất 30-40% thể tích máu (1500-2000 ml) với triệu chứng của mất máu nặng; c) ước tính mất < 25-30% thể tích máu với không có bằng chứng của chảy máu không được kiểm soát, nếu dấu hiệu của giảm thể tích tái phát bất chấp đã được hồi sức; d) ở các bệnh nhân có yếu tố đồng mắc, truyền máu có thể cần thiếu với mức độ mất máu thấp hơn234.
– Các nghiên cứu đánh giá tầm quan trọng của thiếu máu và vai trò truyền máu trong thiết lạp hội chứng vành cấp (đau thắt ngực không ổn định, nhồi máu cơ tim) được đưa ra các kết luận khác nhau234. – Hướng dẫn The American College of Cardiology/American Heart Association and American College of Chest Physicians không tạo ra khuyến cáo nao quan tâm đến lợi ích hay nguy co của truyền máu trong hội chứng vành cấp235,236. Tuy nhiên, trong một nghiên cứu (trial) lâm sàng ở các bệnh nhân hội chứng vành cấp không ST chênh, nguy cơ tử vong tim mạch, nhồi máu cơ tim không tử vong, thiếu máu cơ tim tái phát trong 30 ngày cao hơn đáng kể ở các bệnh nhân có nồng độ Hb <110 g/l so với người có nồng độ Hb ≥ 110 g/l237. – Dù thiếu máu xảy ra thường xuyên ở các bệnh nhân có duy tim, dữ liệu hạn chế là sẵn có cho điều trị thiếu máu ở cộng đồng này. – Điều chỉnh thiếu máu là không phải một điều trị dựa trên bằng chứng trong suy tim như đã được chú ý trong hướng dẫn Heart Failure Society of America 2006, hướng dẫn European Society of Cardiology (ESC) 2012, và hướng dẫn American College of Cardiology/American Heart Association 2009 238–240. – Do đó, chỉ định chung cho truyền hồng cầu cung cấp cho bệnh nhân suy tim; tuy nhiên, nên chú ý cẩn thận với tình trạng thể tích. |
| Khi điều chỉnh Hb nhanh trước phẫu thuật được yêu cầu | – Tiêu chí đã được đưa ra cho truyền máu trước phẫu thuật234. Nhìn chúng không khuyến cáo khi Hb > 100 g/l ở người khỏe mạnh khác, nhưng nên đưa ra khi Hb tháp hơn 70 g/l
– Khi nồng độ Hb thấp hơn 70 g/l và bệnh nhân có tình trạng ổn định, 2 đơn vị hồng cầu nên được truyền và tình trạng lâm sàng và Hb tuần hoàn của bệnh nhân nên được tái đánh giá. – Bệnh nhân nguy cơ cao (>65 tuổi và/hoặc người có bệnh tim mạch hoặc hô hấp) có thể dung nạp thiếu máu kém, và có thể được truyền khi nồng độ Hb < 80 g/l. – Đối với nồng độ Hb giữa 70 và 100 g/l, chiến lược điều chỉnh không rõ ràng |
| Khi triệu chứng và dấu hiệu liên quan đến thiếu máu xuất hiện ở các bệnh nhân điều trị ESA là không hiệu quả (như suy tủy xương, bệnh hemoglobin, kháng ESA) | – Các bệnh nhân thiếu máu mạn (như hội chứng suy tủy xương) mà phụ thuộc truyền hồng cầu trong thời gian lớn hơn tháng hoặc năm, có thể dẫn đến quá tải sắt.
– Xấp xỉ 200 mg sắt được tách ra mỗi đơn vị hồng cầu; sắt này được giải phóng khi Hb từ hồng cầu truyền bị chuyển hóa sau khi hồng cầu chết. – Tiến triển mất hồng cầu thay đổi mà xảy ra trong quá trình dự trữ, các đơn vị máu “tươi nhất sẵn có” nên được lựa chọn trong thứ tự ưu tiên tỷ lệ sống sau truyền máu tối đa. – Hemosiderosis (một dạng rối loạn do quá tải sắt) có thể làm tổn thương tạng khi tổng lượng sắt tiếp cận lên đến 15 đến 20 g, số lượng sắt trong 75 đến 100 đơn vị hồng cầu. – Vấn đề của truyền hồng cầu ở các bệnh nhân với sự mắc phải hoặc thiếu máu tan máu bẩm sinh là phức tạp hơn. |
| Khi các triệu chứng và dấu hiệu với thiếu máu xuất hiện ở các bệnh nhân mà nguy cơ của điều trị ESA có thể cao hơn lợi ích | ESA nên được sử dụng với chú ý lớn, nếu toàn bọ, ở bệnh nhân CKD với bệnh ác tính hoạt động, tiền sử bệnh ác tính, hoặc tiền sử đột quỵ |
NGHIÊN CỨU KHUYẾN CÁO
Có một sự thiếu nghiên cứu (trial) đối chứng ngẫu nhiên trên sử dụng truyền máu như một can thiệp ban đầu thiếu máu và CKD. Đưa ra sự khó khăn hiển nhiên trong các kết luận nghiên cứu đó, nó dường như rằng các dữ liệu quan sát sẽ tiếp tục đến chiếm ưu thế trong khu vực điều trị này.
Các nghiên cứu tương lai gồm:
- Dữ liệu quan sát tiến cứu thu thập trên sử dụng truyền hồng cầu ở các bệnh nhân CKD, đặc biệt các bệnh nhân bao gồm các lý do cho truyền máu, ý định ghép thận trong tương lai, khả năng nhận được ghép thận, và kết quả của tạng ghép.
- Đánh giá quan sát tiến cứu của tác động của truyền hồng cầu trên mức độ mẫn cảm HLA.
- Đưa ra một sự chênh lệch đáng kinh ngạc trong sử dụng truyền máu giữa US và Châu Âu, Canada và Australia trong nghiên cứu TREAT, và giữa US và Châu Âu trong chương trình thử nghiệm lâm sàng peginesatide Phase thứ 3, nghiên cứu sâu hơn là cần thiết để chắc chắn “điều khiển” truyền máu ở bệnh nhân CKD. Có mối liên quan với các dạng thực hành lâm sàng hoặc sự cần thiết cho truyền máu lâm sàng cao hơn thực sự không ở US?
SỰ CHỐI BỎ
Trong khi mọi nỗ lực được tạo ra bởi nhà xuất bản, các nhà biên tập và INS để xem rằng không có dữ liệu, quan điểm hoặc tuyên bố không chính xác hoặc lỗi xuất hiện trong tài liệu này, chúng tôi ước muốn làm nó trở lên rõ ràng rằng các dữ liệu và quan điểm xuất hiện trong bài viết và các quản bá ở đây là trách nhiệm của người đóng góp, người lưu trữ, hoặc người quảng bá. Theo đó, các nhà xuất bản và INS, nhà biên tập và các nhà tuyển dụng, văn phòng và cơ quan không chấp nhận trách nhiệm pháp lý cho các hậu quả của bất kỳ dữ liệu, quan điểm, hoặc tuyên bố không chính xác hoặc lỗi nào. Trong khi mọi nỗ lực được tạo ra để đảm bảo rằng liều thuốc và định lượng khác xuất hiện là chính xác, bạn đọc được khuyên rằng các phương pháp và kỹ thuật mới trong sử dụng thuốc, và được kê trong tài liệu này, nên chỉ được thực hiện kết hợp với tài liệu được công bố bởi chính nhà sản xuất.
| Nội dung trước | Trở lại mục lục | Nội dung tiếp theo |