Xem danh mục các bài liên quan đến tiêm phòng vaccine tại đây
|
BÁO CÁO KỸ THUẬT Tiêm phòng vaccine một phần, tiêm phòng vaccine sau nhiễm SARS-CoV-2 và phác đồ tiêm phòng vaccine dị hợp: tổng hợp bằng chứng ECDC ngày 22 tháng 6 năm 2021 |
TS Nguyễn Hữu Dũng, BSCKI Nguyễn Thanh Hùng dịch
THÔNG ĐIỆP CHÍNH
Tài liệu này cung cấp tổng hợp bằng chứng trên ba chủ đề quan tâm (hiệu quả của tiêm vaccine một phần; tính sinh miễn dịch và hiệu quả của tiêm vaccine cho những đối tượng đã bị nhiễm bệnh từ trước; tính an toàn và sinh miễn dịch của phác đồ tiêm phòng dị hợp) để tạo nền tảng thông tin cho việc đưa ra các quyết định liên quan đến những chính sách và chiến lược tiêm phòng của các quốc gia Liên minh Châu Âu và Khu vực Kinh tế Châu Âu (EU/EEA).
TIÊM PHÒNG VACCINE MỘT PHẦN
– với dữ liệu đã có, ở các nhóm cộng đồng khác nhau và các biến thể quan tâm (VOC) của SARS-CoV-2, đã xác nhận rằng sự bảo vệ trước việc nhiễm bệnh không triệu chứng, có triệu chứng và bệnh nặng bởi việc tiêm hai liều vaccine (Comirnaty, Spikevax và Vaxzevria) là cao hơn đáng kể với tiêm vaccine một phần (tiêm một liều trong phác đồ hai liều). Bằng chứng hạn chế trên hiệu quả kéo dài của tiêm vaccine một phần.
– Bằng chứng trước đây từ một số nghiên cứu chỉ ra rằng người tiêm vaccine một phần ít có khả năng bảo vệ hơn chống loại nhiễm bệnh có triệu chứng với biến thể B.1.672.2 (Delta) so với biến thể B.1.1.7 (Alpha), bất kể loại vaccine nào. Tuy nhiên, tiêm vaccine đầy đủ cung cấp khả năng bảo vệ tương đương cho cả hai biến thể Delta và Alpha.
– Sự hỗ trợ cho khuyến cáo của ECDC trước đây rằng, trong bối cảnh tăng lên của sự quay vòng của biến thể Delta, tiêm phòng vaccine đầy đủ nên đạt được sớm nhất có thể và liều tiêm vaccine thứ hai được tiêm sau một khoảng thời gian ngắn nhất có thể, với sự ưu tiên cho các nhóm cộng đồng có nguy cơ các hậu quả bệnh nặng sau nhiễm SARS-CoV-2 cao.
NGƯỜI BỊ NHIỄM BỆNH TỪ TRƯỚC
– Các nghiên cứu những phác đồ một liều vaccine Comirnaty, Spikevax và Vaxzevria ở những đối tượng đã bị nhiễm bệnh từ trước chỉ ra rằng đáp ứng miễn dịch dịch thể và tế bào là có thể so sánh được với người hoàn thành phác đồ hai liều. Tuy nhiên, dữ liệu với khả năng bảo vệ trong một khoảng thời gian dài vân còn hạn chế.
– Các chú ý phải được thực hiện trong chuyển đổi dữ liệu về tính sinh miễn dịch vào khả năng bảo vệ từ các kết quả lâm sàng COVID-19. Hiện nay chưa có bằng chứng trên các chỉ tiêu lâm sàng cuối cùng, như là nguy cơ nhiễm được xác nhận bằng xét nghiệm và bệnh có triệu chứng, cho người bị nhiễm bệnh từ trước nhận được một liều bằng một loại vaccine yêu cầu tiêm hai liều.
– Với khoảng trống bằng chứng hiện nay, chú ý, cân nhắc nên tiếp tục đưa vào phác đồ hai liều, theo ủy quyền của EMA, đặc biệt cho những người ở mức độ nguy cơ hậu quả lâm sàng nặng sau khi nhiễm SARS-CoV-2 lớn nhất.
NHỮNG PHƯƠNG PHÁP TIÊM VACCINE DỊ HỢP
– Bằng chứng từ các nghiên cứu trên các phác đồ tiêm phòng dị hợp (“hỗn hợp và phù hợp”) đề nghị rằng phối hợp Vaxzevria và các vaccine mRNA mang đến đáp ứng dịch thể mạnh mẽ hơn chống lại SARS-CoV-2 và và gợi ý đáp ứng tế bào T cao hơn các phác đồ phối hợp khác. Mặc dù tính phản ứng toàn thân từ nhẹ đến trung bình sau tiêm liều thứ hai tăng, các phác đồ dị hợp nhìn chung có tính tương hợp tốt.
– Một số nước EU/EEA hiện nay sử dụng phác đồ tiêm “hỗn hợp và phù hợp”, chủ yếu với một vaccine mRNA (Comirnaty hoặc Spikevax) sau một liều Vaxzevria, đặc biệt có biến cố phản ứng nặng sau liều đầu tiên hoặc cho những lý do cần chú ý dựa trên quy trình của từng nước. Bằng chứng hiện nay cung cấp tổng quan khoa học để kỳ vọng về các tiếp cận “dấu nhãn” an toàn và và gợi ý đáp ứng miễn dịch tốt.
– Trong khi nghiên cứu liên tục cung cấp nhiều bằng chứng hơn về tính an toàn trong thời gian dài, thời gian của tính hiệu quả và tính sinh miễn dịch, sử dụng các phác đồ tiêm phòng dị hợp có thể linh hoạt lựa chọn vaccine, đặc biệt giảm nhẹ đi áp lực sản xuất vaccine, hoặc nếu khi sản xuất bị dừng hoặc tạm dừng.
PHẠM VI TÀI LIỆU
Báo cáo kỹ thuật này cung cấp tổng hợp cập nhật bằng chứng liên quan đến:
– tính hiệu quả của tiêm phòng vaccin một phần –liều tiêm đầu tiên của phác đồ tiêm phòng hai liều
– tính sinh miễn dịch và hiệu quả của tiêm phòng vaccine một liều, ở người đã từng nhiễm bệnh SARS-CoV-2.
– tính an toàn và tính sinh miễn dịch của các loại phác đồ tiêm phòng vaccine COVID-19 dị hợp, còn được gọi là tiếp cận “hỗn hợp và phù hợp”.
Tài liệu này tổng hợp từ những bằng chứng đã có cho các loại vaccine COVID-19 được cấp phép sử dụng ở EU/EEA và có ý nghĩa cung cấp liên tục việc hỗ trợ tạo ra quyết định cho các chiến lược và chính sách tiêm phòng vaccine COVID-19 ở các quốc gia EU/EEA.
Thông tin có trong báo cáo này bao gồm:
– Dữ liệu các tổng hợp nhanh lấy từ các bài báo của các chuyên gia và đã được xuất bản từ trước.
– Thông tin trên các chính sách tiêm phòng COVID-19 hiện nay lấy từ các câu hỏi về vaccine đã được gửi từ các quốc gia Cộng đồng chung Châu Âu gửi đến EU/EEA qua Integrated Situational Awareness and Analysis (ISAA) và Bộ máy Ứng phó Khủng hoảng Tích hợp của Liên minh Châu Âu, đặc biệt, báo cáo số 71 ISAA (ngày 28 Tháng 6 năm 2021) và số 72 (ngày 5 Tháng 7 năm 2021), và thu thập qua EU/EEA National Immunisation Technical Advisory Groups (NITAGs) Collaboration từ ngày 23 đến ngày 29 Tháng 6 năm 2021
ĐỐI TƯỢNG MỤC TIÊU
Những đối tượng mục tiêu cho tài liệu này là EC, Ủy ban Bảo vệ Sức khỏe (HSC), EU/EEA NITAGs, Bộ Y tế và Ủy ban Y tế các quốc gia trong EU/EEA, những người đưa ra quyết định y tế ở các quốc gia và ở các mức độ hỗ trợ.
TỔNG QUAN
Đến ngày 19 Tháng 6 năm 2021, 4 loại vaccine nhận được giấy phép đủ điều kiện lưu hành trên thị trường ở EU/EEA sau đánh giá bởi Cơ quan Dược phẩm Châu Âu (EMA) [1] gồm: Comirnaty (BNT162b2) sản xuất bởi BioTech/Pfizer, Spikevax (Mrna-1273) trước đây gọi là Vaccine COVID-19 Moderna, Vaxzevria (AZD1222) trước đây gọi là Vaccine COVID-19 AstraZeneca, và Vaccine COVID-19 Janssen (Ad26.COV 2.5). Comirnaty hiện nay đã được cho phép sử dụng ở người 12 tuổi trở lên [2,3], trong khi các loại vaccine khác hiện nay đăng ký sử dụng cho người 18 tuổi trở lên [3-5].
Tại các nước EU/EEA, việc triển khai chiến dịch tiêm phòng vaccine bắt đầu từ cuối Tháng 12 năm 2020, khi nhà cung cấp vaccine Comirnaty đầu tiên được phân phối, và ngày 19 Tháng 01 năm 2021, EC đã thiết lập hành động từng bước đáp ứng chống lại dịch bệnh và thúc dục việc tăng cường triển khai tiêm phòng vaccine với mục tiêu tiêm phòng cho ít nhất 80% người 80 tuổi trở lên và 80% người khỏe mạnh và nhân viên chăm sóc xã hội ở mỗi nước EU/EEA đến Tháng 3 năm 2021. Ngoài ra, tối thiểu 70% người lớn (trên 18 tuổi) được tiêm phòng vào mùa hè năm 2021 [6].
Hơn nữa, các nước ưu tiên cho người cao tuổi (với các mức độ tuổi khác nhau), người nằm viện và người cần chăm sóc y tế lâu dài (LTCFs), nhân lực y tế và dần dần tiến tới các đối tượng chăm sóc xã hội, người có bệnh lý nền và người trẻ tuổi hơn. Trong khi đó, một số nước mở rộng tiêm phòng cho toàn bộ, ngày 19 Tháng 6 năm 2021, trên 419 triệu liều đã được tiêm cho người lớn trên 18 tuổi ở EU/EEA. Tỷ lệ tiêm phòng ít nhất một liều vaccine đạt tới 66.4% và 49.2% cho tiêm phòng đầy đủ ở EU/EEA (với 30 nước đã báo cáo). Ba mươi quốc gia (với 27 báo cáo) đã tiêm vaccine đầy đủ cho hơn 80% dân số trên 80 tuổi (80+), tám nước (17 báo cáo) đã tiêm đầy đủ vaccine cho hơn 80% nhân viên y tế. Dữ liệu tiêm phòng vaccine thực hiện tại EU/EEA có thể tìm trong ECDC Vaccine Tracker [7].
Sự xuất hiện và lây lan của các biến thể đáng quan tâm (VOCs) mang đến những thách thức đáng kể, đặc biệt biến thể SARS-CoV-2 Delta (B.1.617.2), sự tuần hoàn nhiễm bệnh tăng ở các nước EU/EEA. Biến thể này lây truyền nhanh hơn 40-60% biến thể Alpha (B.1.1.7) và có liên quan đến nguy cơ nhập viện cao hơn. Dựa trên khả năng lây truyền đã ước tính của biến thể Delta và sử dụng các mô hình tiên đoán, ước tính cho đến Tháng 8, 70% ca nhiễm mới sẽ do biến thể này ở Châu Âu. Ngày 15 Tháng 6, dữ liệu đến từ 16 quốc gia EU/EEA cho thấy tỷ lệ biến thể Delta ở các mẫu thu nhận được là 39.1% (khoảng 0.7-87.3%), dù biến thể Alpha vẫn chiếm tỷ lệ cao hơn với trung bình 42.5% (2.1 – 95.8%). Cùng thời gian này, dữ liệu hiện nay cho thấy tăng 64.3% ca bệnh COVID-19 mới mỗi tuần trong tuần thứ 27 so với các tuần trước, với xu hướng tăng cũng quan sát được ở 20 nước. Đối tượng tăng nhanh nhất đã báo cáo, là độ tuổi từ 15 đến 24 tuổi, tăng thấp hơn hơn ở người trên 65 tuổi [9].
Trong khi các nước EU/EEA thực hiện chiến dịch tiêm phòng vaccine, họ liên tục điều chỉnh chính sách và chiến lược tiêm phòng dựa trên tình huống dịch tễ, thực tế của cung cấp vaccine, và bằng chứng khoa học trên virus và hiệu năng của vaccine. Tài liệu này cung cấp tổng hợp bằng chứng trên tính an toàn, tính sinh miễn dịch, hiệu quả tiêm phòng vaccine COVID-19 trên 3 mực tiêu (tiêm phòng một phần, tiêm phòng vaccine ở người đã bị nhiễm bệnh và phác đồ tiêm phòng dị hợp) để tạo thông tin liên tục cho các chính sách và chiến lược tiêm phòng vaccine.
1. TIÊM PHÒNG VACCIN MỘT PHẦN
Ngoại trừ Vaccine Janssen, toàn bộ các loại vaccine khác được cấp phép sử dụng ở Châu Âu đòi hỏi phác đồ tiêm phòng 2 liều để hoàn thành thời gian tiêm phòng đầu tiên theo tổng hợp của đặc tính sản phẩm (SPC) của EMA. Theo ước tính, con số tuyệt đối là trên 236 triệu người lớn ở EU/EEA đã hoàn thành tiêm phòng một phần – họ chỉ nhận được 1 liều tiêm trong phác đồ tiêm phòng 2 liều bằng phác đồ tiêm phòng vaccine COVID-19.
Dưới đây, chúng tôi tổng hợp bằng chứng hiệu quả của tiêm phòng vaccine COVID-19 một phần từ các nghiên cứu ngẫu nhiên và quan sát ở các nhóm cộng đồng và các biến thể khác nhau.
1.1. Dữ liệu từ các nghiên cứu ngẫu nhiên
Ở thử nghiệm Comirnaty, giảm nhiễm bệnh có triệu chứng là 52.4% (95%CI: 29.5 – 84.5) sau khi tiêm liều đầu tiên quan sát được ở những người trong thử nghiệm. Tuy nhiên, thử nghiệm này chỉ 13 ngày sau tiêm phòng liều đầu, khi khả năng bảo vệ chưa được thiết lập, và khi đến 21 ngày (thời điểm để tiêm phòng mũi vaccine thứ 2). So sánh với 94.8% (95%CI: 89.8 – 97.6) hiệu quả chống lại nhiễm bệnh có triệu chứng 7 ngày tiêm sau liều thứ hai [10].
Thử nghiệm Spikevax cho thấy 80.2% (95%CI: 55.2 – 92.5) hiệu quả bảo vệ nhiễm bệnh có triệu chứng sau liều đầu tiên với thời gian theo dõi trung bình 28 ngày (khoảng 1 – 108 ngày). Tuy nhiên, như thử nghiệm Comirnaty, phân tích này cũng chỉ 13 ngày sau liều đầu tiên, thời gian theo dõi trung bình ngắn dẫn đến hạn chế việc giải thích kết quả [11]. So sánh với hiệu qủa 94.1% (95%CI: 89.3 – 96.8) chống lại nhiễm bệnh có triệu chứng sau liều tiêm thứ hai.
Từ phân tích tổng hợp dữ liệu trong thử nghiệm Vaxzevria có ước tính khác của bảo vệ chống lại nhiễm bệnh có triệu chứng quan sát từ ngày thứ 22 đến ngày thứ 90 sau liều thứ nhất, khoảng từ 50% đến 80%. Hiệu quả vaccine là 81.3% (95%CI: 60.3 – 91.2) quan sát từ ngày thứ 14 sau liều thứ hai ở những người nhận được liều tiêm chuẩn với khoảng cách từ 12 tuần trở lên [13]. Trong thử nghiệm Vaxzevria, các đối tượng nghiên cứu tự tiến hành lấy bệnh phẩm qua mũi và họng hàng tuần, kết quả xét nghiệm PCR dương tính giảm 63.9% (95%CI:46-75.9) giữa ngày thứ 22 và ngày thứ 90 sau một liều chuẩn [13].
1.2. Dữ liệu từ nghiên cứu quan sát
1.2.1. Cộng đồng chung
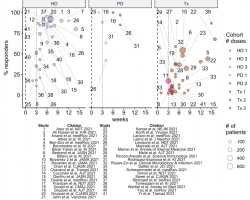
Các nghiên cứu báo cáo dựa trên dữ liệu từ cộng đồng chung trên tính hiệu quả của tiêm phòng vaccine một phần được công bố từ Israel [14-18], Hoa Kỳ [19,20] và Thụy Điển [22] và kết quả được tổng hợp ở Bảng 1 đến Bảng 3.
Một nghiên cứu lớn thực hiện ở Israel bởi Dagan và cs [14], bao gồm 596.618 người đã tiêm phòng vaccine đối chứng 1 – 1 với nhóm chứng không tiêm phòng, thấy rằng tiêm phòng vaccine với một liều Comirnaty có hiệu quả chống lại nhiễm SARS-CoV-2 bất kỳ được ghi nhận (46%; 95%CI 40-51), nhiễm bệnh có triệu chứng (57%; 95%CI 50-63), nhập viện (74%; 95%CI:56-86), bệnh nặng (62%; 95%CI: 39-80), và tử vong (72%; 95%CI: 19 – 100) trong thời gian theo dõi ngắn 14 – 20 ngày sau liều đầu tiên và trước khi tiêm liều thứ hai. Tính hiệu quả cải thiện từ 7 ngày trở lên sau tiêm liều thứ hai. Dữ liệu đã được thu thập từ ngày 20 Tháng 12 năm 2020 đến ngày 01 Tháng 02 năm 2021 trong khi có sự tăng lên của biến thể Alpha (lên đến 80% ở cuối của thời gian nghiên cứu).
Dựa trên phân tích thu thập được bởi Hass và cs [16] qua cơ sở dữ liệu quốc gia 4 Tháng đầu tiên của Chương trình Tiêm phòng Quốc gia Israel, ở người 16 tuổi trở lên, tính hiệu quả của vaccine ước tính từ ngày thứ 14 đến ngày thứ 21 sau liều Comirnaty đầu tiên là 52% (95%CI: 48.9 – 55.0) đối với nhiễm SARS-CoV-2 không triệu chứng, 62.5% (95% CI: 59.3−65.4) đối với nhiễm bệnh có triệu chứng, 75.7% (95% CI: 72.0-79.0) đối với nhập viện, 75.6% (95% CI: 71.9-78.9) đối với bệnh nặng và nguy kịch, 77.0% (95% CI: 69.7–82.6) đối với tử vong. Hiệu quả tăng đáng kể đối với toàn bộ kết quả từ hai tuần sau tiêm liều thứ hai, tương ứng là 93.8% (95% CI: 93.3–94.2), 97.7% (95% CI: 97.5−97.9), 98.0% (95% CI: 97.7−98.3), 98.4% (95% CI: 98.1−98.6) và 98.1% (95% CI: 97.6−98.5).
Một nghiên cứu có phạm vi lớn thứ hai tại Israel tiến hành bởi Goldberg và cs (xuất bản trước) chỉ dựa trên dữ liệu đăng ký, đề nghị thấp nhưng tính hiệu quả có ý nghĩa thống kê đáng kể lên đến hai tuần sau tiêm liều Comirnaty đầu tiên: 20.6% (95% CI: 19.7−21.4) đối với nhiễm SARS-CoV-2 được ghi nhận, 45.7% (95% CI: 43.1−48.2) đối với nhập viện, 49.3% (95% CI: 45.7−52.7) đối với bệnh nặng và 48.5% (95% CI: 42.8−53.7) tử vong. Tính hiệu quả tăng lên khi đánh giá thời gian giữa hai tuần sau tiêm liều đầu tiên và lên đến 6 ngày sau tiêm liều thứ hai: 57.7% (95% CI: 57.1−58.4) đối với nhiễm SARS-CoV-2 được ghi nhận; 69.4% (95% CI: 67.5−71.2) đối với nhập viện; 65.9% (95% CI: 63.1−68.5) đối với bệnh nặng; và 62.7% (95% CI: 58.0−66.8) đối với tử vong [16].
Theo một nghiên cứu quan sát, được thực hiện bởi Heymann và cs (xuất bản trước), ở phân nhóm cộng đồng người bệnh từ một cơ quan bảo vệ sức khỏe tại Isael, những người đã xét nghiệm lại SARS-CoV-2 bằng PCR từ ngày 01 Tháng 01 năm 2021 đến ngày 11 Tháng 02 năm 2021, hiệu quả ước tính chống lại nhiễm SARS-CoV-2 hai tuần sau tiêm liều vaccine Comirnaty đầu tiên là 61% (95%CI: 49-71) và 89% (95%CI: 82-94) sau liều thứ hai [17].
Một nghiên cứu đoàn hệ hồi cứu thực hiện bởi Tande và cs tại Hoa Kỳ (US) tại khuôn viên trường Y Mayo ở người bệnh không triệu chứng đã được sàng lọc SARS-CoV-2 trong 48 – 72 giờ trước khi thực hiện phẫu thuật hoặc thủ thuật [19]. Toàn bộ 48.333 xét nghiệm phân tử được tiến hành ở 39.156 bệnh nhân không triệu chứng. Trong đó có 3.006 bệnh nhân đã được tiêm vaccine trong đoàn hệ, 2.299 bệnh nhân chỉ được tiêm 1 liều trước khi sàng lọc và phần lớn tiêm bằng Comirnaty. Phân tích đã cho thấy rằng nguy cơ nhiễm bệnh không triệu chứng ở người bệnh đã tiêm vaccine 10 ngày sau liều Comirnaty hoặc Spikevax đầu tiên là giảm 79% (RR (risk redution) = 0.21; 95%CI: 0.12-0.37).
Một nghiên cứu thiết kế đối chứng ca bệnh xét nghiệm âm tính (n=325) thực hiện bởi Andrejko và cs (xuất bản trước) [20] tại California, US, ước tính tính hiệu quả chống nhiễm bệnh SARS-CoV-2 xác nhận bằng PCR dương tính là 66% (95%CI: 69-93%) và 78% (95%CI: 23-94%), tương ứng một tuần sau tiêm liều đầu tiên và sau tiêm liều thứ hai của một loại vaccine mRNA [20]. Khả năng bảo vệ cho tiêm phòng vaccine mRNA một phần chống lại hậu quả bệnh nặng là 77% (95% CI: 71−82) đối với nhập viện và 64.2% (95% CI: 13.0−85.2) đối với tử vong, trong khi tính hiệu quả của tiêm phòng đầy đủ là 96% (95% CI: 95−99) và 98.7% (95% CI: 91.0−99.8), tương ứng.
Một nghiên cứu đoàn hệ tiến cứu được thực hiện tại Tây Ban Nha bởi Martinez-Baz và cs điều tra tính hiệu quả vaccine ở 20.961 người tiếp xúc gần với các ca bệnh nhiễm SARS-CoV-2 sau một đến hai liều là 35% (95% CI: 25−44) và 66% (95% CI: 57−74) chống lại nhiễm bệnh không triệu chứng, tương ứng, và 72% (95% CI: 47−85) và 95% (95% CI: 62−99) chống lại nguy cơ nhập viện. Các đối tượng nghiên cứu đã được tiêm phòng vaccine là một trong 3 loại Comirnaty, Spikevax hoặc Vaxzevria.
Trong một nghiên cứu đoàn hệ tại Thụy Điển bởi Bjork và cs (xuất bản trước), tính hiệu quả vaccine ước tính trong phòng ngừa nhiễm SARS-CoV-2 bất kỳ ít nhất 7 ngày sau liều Comirnaty thứ hai là 86% (95%CI: 72-94) và 42% (95%CI: 14 – 63) ở ngày 14 sau tiêm liều đâu tiên [22].
Bảng 1. Tính hiểu quả Vaccine được điều chỉnh [%, (95%CI) thời gian sau tiêm]; của một và hai liều chống lại nhiễm SARS-CoV-2 (bất kỳ, có triệu chứng, không triệu chứng) trong cộng đồng chung như được báo cáo trong các nghiên cứu đã xuất bản/ các nghiên cứu được phê duyệt (đến 14 Tháng 6 năm 2021)
| Comirnaty | Phân tích tổng hợp cho nhiều sản phẩm | Tham khảo | |||
| Liều 1 | Liều 2 | Liều 1 | Liều 2 | ||
| Nhiễm bệnh bất kỳ | 46% (40-51)
14-20 ngày |
92% (88-95)
≥7 ngày |
[14] | ||
| 61% (49-71)
≥2 tuần |
89% (82-94)
Không rõ |
[17]^ | |||
| C/S
66% (69-93) ≥7 ngày |
C/S
78% (23-94) ≥7 ngày |
[20]^ | |||
| C/S/V
35% (25-44) ≥14 ngày |
C/S/V
66% (57-74) ≥14 ngày |
[21] | |||
| 42% (14-63)
≥14 ngày |
86% (72-94)
≥7 ngày |
[22]^ | |||
| Có triệu chứng | 57% (50-63)
14-20 ngày |
94% (87-98)
≥7 ngày |
[14] | ||
| 62.5% (59.3 – 65.4)
14-21 ngày |
97.7% (97.5-97.9)
≥7 ngày |
[16] | |||
| 20.6% (19.7-21.4)
Lên đến 2 tuần sau liều đầu tiên 57.7% (57.1-58.4) từ hai tuần sau liều đầu đến 6 ngày sau liều thứ hai |
92.8% (92.6-93.0)
≥7 ngày |
[18]^ |
|||
| C/S/V
42% (31-52) ≥14 ngày |
C/S/V
82% (74-88) ≥14 ngày |
[21] |
|||
| Không triệu chứng | 52% (48.9-55.0)
14−21 ngày |
93.8% (93.3-94.2)
≥7 ngày |
[16] | ||
| C/S
79% (63-88) ≥10 ngày |
– |
[19]^ |
|||
| C: Comirnaty; S: Spikevax; V: Vaxzevria’ ^: xuất bản từ trước | |||||
Bảng 2: Tính hiệu quả vaccine điều chỉnh [%; (95%CI), thời gian sau tiêm] của một và hai liều. Tính hiệu quả vaccine COVID-19 điều chỉnh chống lại bệnh nặng và nhập viện trong cộng đồng chung như được báo cáo trong xuất bản trước/các nghiên cứu được phê duyệt (đến 14 Tháng 6 năm 2021)
| Comirnaty | Phân tích tổng hợp cho nhiều sản phẩm | Reference | |||
| Liều 1 | Liều 2 | Liều 1 | Liều 2 | ||
| Bệnh nặng | 62% (39-80)
14-20 ngày |
92% (75-100)
≥7 ngày |
[14] | ||
| 49.3%
(45.7-52.7), lên đến hai tuần sau liều đầu tiên 65.9% (63.1- 68.5) Từ hai tuần sau liều đầu tiên đến 6 ngày su kiều thứ hai |
94.4% (93.6-95.0)
≥7 ngày |
[18]^ | |||
| Nhập viện | 74% (56-86)
14-20 ngày |
87% (55-100)
≥7 ngày |
[14] | ||
| Nhập viện bất kỳ
75.7% (72.0-79.0) 14-21 ngày Đối với bệnh nặng 75.6% (71.9-78.9) 14-21 ngày |
Nhập viện bất kỳ
98.0% (97.7-98.3) ≥7 ngày Đối với bệnh nặng 98.4% (98.1-98.6) ≥7 ngày |
[16] | |||
| 45.7% (43.1-48.0)
Lên đến hai tuần sau liều đầu tiên 69.4% (67.5-71.2) Từ hai tuần sau liều đầu tiên đến 6 ngày sau liều thứ hai |
94.2% (93.6-94.7)
≥7 ngày |
[18]^ | |||
| C/S
77% (71-82) ≥7 ngày |
C/S
96% (95-99) ≥7 ngày |
[20]^ | |||
| C/S/V
72% (47-85) ≥14 ngày |
C /S/V
95% (62-99) ≥14 ngày |
[21] | |||
| C: Camirnaty; S: Spikevax; V: Vaxzevria’ ^: xuất bản từ trước | |||||
Bảng 3: Tính hiệu quả vaccine điều chỉnh [%; 95%CI; thời gian sau tiêm]. Tính hiệu quả vaccine COVID-19 chống lại tử vong trong cộng đồng chung như đã báo cáo trong các nghiên cứu xuất bản trước/các nghiên cứu được phê duyệt (đến 14 Tháng 6 năm 2021).
| Comirnaty | Phân tích tổng hợp cho nhiều sản phẩm | Tham khảo | |||
| Tử vong | Liều 1 | Liều 2 | Liều 1 | Liều 2 | |
| 72% (19-100)
14-20 ngày |
– | [14] | |||
| 77.0% (69.7-82.6)
14-21 ngày |
98.1% (97.6-98.5)
≥7 ngày |
[16] | |||
| 48.5% (42.8-53.7)
Lên đến hai tuần sau liều đầu tiên 62.7% (58.0-66.8) Từ hai tuần sau liều đầu tiên đến 6 ngày sau liều thứ hai |
93.7% (92.5-94.7)
≥7 ngày |
[18]^ | |||
| C/S
64.2% (13.0-85.2) ≥7 ngày |
C/S
98.7% (91.0-99.8) ≥7 ngày |
[20]^ | |||
| C: Camirnaty; S: Spikevax; V: Vaxzevria’ ^: xuất bản từ trước | |||||
1.2.2. Những người có nguy cơ COVID-19 nặng, người cao tuổi và người nằm viện chăm sóc y tế kéo dài (LTFC)
Những nghiên cứu ở cộng đồng nguy cơ đã được tiến hành ở Đan Mạch [23,24], Israel [18], USA [25, 26], Anh [25, 27. 28] và Tây Ban Nha [21, 29, 30]. Kết quả từ các nghiên cứu quan sát ở người già, LTCF và các đối tượng khác ở nguy cơ được trình bầy ở dưới và tổng hợp trong Bảng 4 đến 6.
Tại Đan Mạch, đường link dữ liệu của rất nhiều đăng ký y tế cộng đồng đã cung cấp ước tính sớm của tính hiệu quả vaccine ở nhiều nhóm ưu tiên.
Một nghiên cứu đầu tiên được thực hiện bởi Moustsen-Helm và cs (xuất bản trước) từ 27 Tháng 12 năm 2020 đến 18 Tháng 2 năm 2021 ở người LTCF, 39.040 tiêm Comirnaty. Không có tính sinh miễn dịch đáng kể chống lại nhiễm bệnh nào quan sát được ở người LTCF ở bất kỳ thời điểm nào ở khoảng thời gian giữa liều tiêm thứ nhất và liều tiêm thứ hai. Tính sinh miễn dịch được đo 7 ngày sau tiêm của liều thứ hai là 64% (95%CI: 14-84) [24].
Một nghiên cứu thứ hai bởi Emborg và cs (xuất bản trước) [24], tiến hành sử dụng cùng nguồn dữ liệu đến tận ngày 11 Tháng 4 năm 2021, kết luận rằng ở các nhóm đối tượng ưu tiên (người LTCF, trên 85 tuổi, trên 65 tuổi và cần hỗ trợ ở nhà, người có bệnh lý nền và người chăm sóc y tế), tính hiệu quả toàn bộ chống lại nhiễm bệnh cao hơn đáng kể từ ngày thứ 7 sau liều tiêm thứ hai (82%; 95% CI: 79−84) so sánh với từ ngày 0 đến ngày thứ 7 sau liều tiêm thứ nhất (42%; 95% CI: 33−50) [23]. Hiệu quả toàn bộ chống lại nhập viện (93%; 95% CI: 89−96) và tử vong (94%, 95% CI: 90−96) do COVID-19 cao hơn từ ngày thứ 7 trở đi sau liều tiêm thứ hai.
Một nghiên cứu quan sát (xuất bản trước) được thực hiện tại Israel bởi Goldberg và cs [18] (xem phần trước) báo cáo hiệu quả vaccine theo nhóm tuổi. Ở người có độ tuổi 80+, hiệu quả vaccine chống lại các hậu quả được nghiên cứu thấp hơn từ ngày thứ 14 sau liều đầu tiên và 7 ngày sau liều tiêm thứ hai, so sánh với ngày thứ 7 sau liều tiêm thứ hai: 36.6% (95% CI: 32.6−40.3) so với 85.6% (95% CI: 84.3−86.7) chống lại nhiễm bệnh; 54.1% (95% CI: 49.2−58.6) so với 91.9% (95% CI: 90.4−93.2) chống lại nhập viện; 55.8% (95% CI: 50.4−60.6) so với 91.2% (95% CI: 89.8−92.4) chống lại nhập viện với bệnh nặng; và 56.6% (95% CI: 49.3−62.8) so với 92.6% (95% CI: 90.6−94.1) chống lại tử vong. Hiệu quả vaccine quan sát ở người có độ tuổi 80+ thấp hơn bất kỳ nhóm có độ tuổi trẻ hơn nào.
Trong một nghiên cứu đối chứng ca bệnh thực hiện bởi Tendorde và cs ở người nhập viện tuổi 65 trở lên tại US, tính hiệu quả vaccine điều chỉnh chống lại nhập viện liên quan đến COVID-19 là 94% (95%CI: 49 – 99) sau tiêm phòng đầy đủ (cả hai liều trong phác đồ tiêm hai liều, với liều thứ hai nhận được từ 14 ngày trở lên trước khi bị bệnh) với một trong hai loại Comirnaty hoặc Spikevax và 64% (95% CI: 28−82) sau tiêm vaccine một phần (một liều từ 14 ngày trở lên trước khi bị bệnh) [26].
Một nghiên cứu đối chứng ca bệnh test âm tính thực hiện bởi Bernal và cs tại Anh sử dụng cơ sở dữ liệu y tế (156.930 người lớn từ 70 tuổi trở lên) đánh giá hiệu quả vaccine chống lại nhiễm bệnh có triệu chứng ở các thời điểm khác nhau so sánh với nguy cơ nhiễm bệnh ban đầu trong giai đoạn sớm sau tiêm vaccine (4-9 ngày) [27]. Ở người tuổi 80+ từ nghiên cứu cộng đồng, hiệu quả chống lại nhiễm bệnh có triệu chứng đạt tới 70% (95%CI: 59-78) ở ngày thứ 28 đến ngày thứ 34 sau một liều Comirnaty, tiếp đó là đạt đỉnh cao nguyên, nhưng tăng lên 89% (95%CI: 85 – 93) từ ngày thứ 14 sau liều thứ hai. Ở người độ tuổi 70+, hiệu quả chống lại nhiễm bệnh có triệu chứng đạt tới 60% (95% CI: 41−73) ở ngày thứ 28 đến ngày thứ 34 sau liều vaccine Vaxzevria đầu tiên và 73% (95% CI: 27−90) từ ngày thứ 35 trở đi. So sánh với nguy cơ ban đầu, nguy cơ nhập viện cấp cứu giảm 43% (95% CI: 33−52) và nguy cơ tử vong giảm 51% (95% CI: 37−62) ở người tiêm một liều Comirnaty. Ở người tiêm một liều Vaxzevria, nguy cơ nhập viện cấp cứu giảm 37% (95% CI: 3%−59%), khi ước tính từ 14 ngày sau tiêm, sau đó không có sự đánh giá đầy đủ hiệu quả của Vaxzevria trên tỷ lệ tử vong.
Một nghiên cứu khác được thực hiện bởi Shrotri và cs (xuất bản trước) ở Anh với đối tượng LTCF (tuổi trung bình 86) so sánh hiệu quả vaccine của liều vaccine Vaxzevria hoặc Comirnaty chống lại nhiễm SARS-CoV-2 sử dụng cơ sở dữ liệu y tế. Cả hai loại vaccine liên quan với giảm nguy cơ nhiễm bệnh từ tuần thứ 4 đến ít nhất là tuần thứ 7 sau tiêm phòng. Hiệu quả của liều đầu tiên ước tính là 56% (95% CI: 19−76) ở ngày thứ 28 đến ngày thứ 34 và 62% (95% CI: 23−81) ở ngày 35 đến ngày thứ 48 sau một liều Comirnaty hoặc Vaxzevria [28]. Ước tính là tương tự với người được quan sát bởi Britton và cs (từ ngày thứ 14 sau liều đầu tiên đến 7 ngày sau liều thứ hai) là 63% (95%CI: 33-79) hiệu quả trong phòng ngừa nhiễm SARS-CoV-2 [25].
Trong một nghiên cứu đoàn hệ dựa trên dữ liệu đăng ký thực hiện bởi Mone và cs (xuất bản trước) ở Tây Ban Nha ở người LTCF tuổi trên 65 được tiêm vaccine Comirnaty từ ngày 27 Tháng 12 năm 2020 đến ngày 10 Tháng 3 năm 2021, hiệu quả vaccine toàn bộ chống lại nhiễm SARS-CoV-2 được ghi nhận ở các đối tượng có hoặc không có tiền sử nhiễm COVID-19 là 51% (95% CI: 49.7−52) 15−21 ngày sau tiêm liều đầu tiên, 61.9% (95% CI: 60.8−63) 22−28 ngày sau liều đầu tiên và 81.2% (95% CI: 80.2−82.7) từ ngày 29 sau liều đầu tiên (lưu ý thời gian từ ngày thứ 7 sau thời gian tiêm trung bình của liều thứ hai là 21 ngày sau liều đầu tiên [30]. Ước tính gần hơn từ cùng một nghiên cứu công bố bởi Mazagatos và cs cho thấy rằng hiệu quả vaccine của một liều (từ ngày thứ 14 sau tiêm) trong phòng ngừa nhiễm SARS-CoV-2, nhiễm SARS-CoV-2 không triệu chứng, nhập viện và tử vong là 50.5% (95% CI: 37.1−61.1), 58.0% (95% CI: 41.7−69.7), 53.0% (95% CI: 25.7−70.3) và 55.6% (95% CI: 26.6−73.2), tương ứng. Ước tính hiệu quả vaccine đầy đủ là 71.4% (95% CI: 55.7−81.5), 69.7% (95% CI: 47.7−82.5), 88.4% (95% CI: 74.9−94.7) và 97.0% (95% CI: 91.7−98.9), tương ứng [29].
Nghiên cứu cuối cùng thực hiện bởi Martinez-Baz và cs trong cộng đồng chung ở Navarre, Tây Ban Nha báo cáo rằng ở người tuổi 60 trở lên, hiệu quả của Comirnaty chống nhiễm bệnh có triệu chứng từ ngày thứ 14 sau tiêm liều đầu là 30% (95% CI: 10−35) và 77% (95% CI: 56−88) từ ngày thứ 14 sau liều đầu tiên và từ ngày 14 sau liều thứ hai, tương ứng, của bất kỳ loại vaccine nào (Comirnaty, Spikevax hoặc Vaxzeria) [21].
Bảng 4: Hiệu quả vaccine điều chỉnh [%; (95%CI); thời gian sau tiêm của một và hai liều chống nhiễm SARS-CoV-2 (bất kỳ, có triệu chứng, không có triệu chứng) ở các đối tượng nguy cơ hậu quả COVID-19 nặng, người già, và người LTCF như báo cáo trong xuất bản trước/các nghiên cứu được phe duyệt (đến 14 Tháng 6 năm 2021).
| Comirnaty | Vaxzevria | Phân tích tổng hợp cho nhiều sản phẩm | Tham khảo | ||||
| Liều 1 | Liều 2 | Liều 1 | Liều 2 | Liều 1 | Liều 2 | ||
| Nhiễm bệnh bất kỳ ở đối tượng LTCF | 63% (33-79) | [25] | |||||
| 65% (29-83)
ở 35-48 ngày |
68% (34-85) | V/C
56% (19-76) ở 28–34 ngày 62% (23-81) ở 35-48 ngày |
[28]^ | ||||
| 21% (-11-44)
>14 ngày |
64% (14-84)
>14 ngày |
[24]^ | |||||
| -17% (-45-50)
≥14 ngày đến liều thứ hai |
11% (-25-37)
0-7 ngày 53% (29-69) >7 ngày |
[23]^ | |||||
| 51% (49.7-52.3)
15-21 ngày
61.9% (60.8-63) 22-28 ngày |
81.2% (80-82)
≥29 ngày sau liều 1 |
[30]^ | |||||
| S/C
50.5% (37.1- 61.1) >14 ngày |
S/C
71.4% (55.7- 81.5) ≥7 ngày |
[29] | |||||
| Nhiễn bệnh có triệu chứng ở người LTCF | S/C
58.0% (41.7- 69.7) >14 ngày |
S/C
69.7% (47.7- 82.5) ≥7 ngày |
[29] | ||||
| Nhiễm bệnh bất kỳ ở người 65+ sống ở nhà cần hỗ trợ | 31% (6- 50)
14 ngày until Liều 2 |
71% (46-85)
0-7 ngày
86% (78-91) >7ngày |
[23]^ | ||||
| Nhiễm bệnh có triệu chứng ở người 60+ | 30% (10-35)
≥14 ngày |
77% (56-88)
≥14 ngày |
[21] | ||||
| Nhiễm bệnh không triệu chứng ở người 70+ | 73% (27-90)
>35 ngày# |
[27] | |||||
| Nhiễm bệnh bất kỳ ở người 80+ | 17.2% (12.4-
21.7) lên đến hai tuần sau tiêm liều đầu tiên 36.6% (32.6- 40.3) Từ hai tuần sau liều đầu tiên đến 6 ngày sau tiêm liều thứ hai |
85.6% (84.3-86.7)
7 ngày |
[18]^ | ||||
| Nhiễm bệnh có triệu chứng ở người 80+ | 70% (59-78)
2-34 ngày |
89% (85-93)
≥14 ngày |
[27] | ||||
| Nhiễm bệnh bât kỳ ở người 85+ | 22% (–47-58)
from 14 ngày until Liều 2 |
55% (–9-82)
0-7 ngày
77% (50-89) >7ngày |
[23]^ | ||||
| Nhiễm bệnh bất kỳ ở người nguy cơ bệnh COVID-19 nặng | 19% (–4-38)
Từ 14 ngày đến liều thứ 2 |
53% (32-68)
0-7 ngày
71% (58-80) >7 ngày |
[23]^ | ||||
| S (Spikevax), C (Comirnaty), V (Vaxzeria). ^Preprint; | |||||||
Table 5. Hiệu quả vaccine điều chỉnh [% (95% CI); time after injection] của một hoặc hai liều chống lại nhập viện liên quan đến COVID-19 ở người nguy cơ bệnh COVID-19 nặng, người cao tuổi, người LTCF như đã được báo cóa trong xuất bane trước/các nghiên cứu đã được chấp thuận.
| Comirnaty | Vaxzevria | Phân tích tổng hợp cho nhiều sản phẩm | Tham khảo | ||||
| Liều 1 | Liều 2 | Liều 1 | Liều 2 | Liều 1 | Liều 2 | ||
| LCTF residents | 44% (38-50)*
14 ngày đến khi tiêm liều thứ hai 34% (4-55)** 14 ngày đến khi tiêm liều thứ hai |
50% (43-56)*
0-7 ngày 84% (56-94)** 0-7 ngày 50% (45-55)* >7 ngày 75% (46-89)** >7 ngày |
[23]^ | ||||
| C/V
53.0% (25.7-70.3) |
C/V
88.4% (74.9-94.7) |
[29] | |||||
| >14 ngày | ≥7 ngày | ||||||
| Những đối tượng 65 tuổi sống ở nhà cần hỗ trợ | 28% (23-33)*
14 ngày đến liều thứ hai 36% (-13-63)** 14 ngày đến liều thứ hai |
39% (33-44)*
0-7 ngày 95% (61-99) ** 0-7 ngày 37% (34-41)* >7 ngày 87% (70-95)** >7 ngày |
[23]^ | ||||
| Người nguy cơ bệnh COVID-19 nặng
|
13% (7-18)*
14 ngày đến liều thứ hai 18% (-48-54)** 14 ngày đến liều thứ hai |
15 (8-20)*
0-7 ngày 92% (42-99)** 0-7 ngày -1% (-3 − -17)* >7 ngày 81% (49-93)** >7 ngày |
[23]^ | ||||
| Người 65+ | C/S
64% (28-82) ≥14 ngày |
C/S
94% (49-99) ≥14 ngày |
[26] | ||||
| Người 80+ | 43% (33-52) | 37% (3-59) | [27] | ||||
| 2-34 ngày | ≥14 ngày | ||||||
|
|
32.6% (26.3-
38.5) 0-14 ngày 54.1% (49.2- 58.6) ≥14 ngày đến 7 ngày sau tiêm liều thứ hai |
91.9% (90.4-93.2)
>7 ngày |
[18]^ | ||||
| Người 80+ (nhập viện do bệnh nặng) | 36.2% (29.2-
42.4) 0-14 ngày 55.8% (50.4- 60.6) ≥14 ngày đến 7 ngày sau tiêm liều thứ hai |
91.2% (89.8-
92.4) >7 ngày |
[18]^ | ||||
| Người 85+ | 27% (18-35)*
≥14 ngày 66% (-18-90)** 14 ngày đến liều thứ hai |
48% (41-54)*
0-7 ngày 45% (39-51)* >7 ngày Không có dữ liệu trên COVID- 19 thêm |
[23]^ | ||||
S (Spikevax), C (Comirnaty), V (Vaxzeria). *All cause admissions; **COVID-19-related admissions. ^Preprint
Table 6. Hiệu quả vaccine điều chỉnh [% (95% CI); thời gian tiêm] của một và hai liều chống lại tử vong liên quan đến COVID-19 ở các đối tượng nguy cơ bệnh COVID-19 nặng, người cao tuổi và người LTCF như đã được báo cáo ở xuất bản trước/các nghiên cứu được chấp thuận (đến ngày 14 Tháng 6 năm 2021)
| Comirnaty | Vaxzevria | Phân tích tổng hợp cho nhiều sản phẩm | Tham khảo. | ||||
| Liều 1 | Liều 2 | Liều 1 | Liều 2 | Liều 1 | Liều 2 | ||
| Tử vong ở người LTCF | -23% (-9 – -39)*
14 ngày đến liều thứ hai -2% (-35-23)** 14 ngày đến liều thứ hai |
63% (54-70)
0-7 ngày* Không ước tính cho tử vong liên quan đến COVID-19 ở ngày 0 – 7 26% (17-34)* >7 ngày 89% (81-93)** >7 ngày |
[23]^ | ||||
| C/S
55.6% (26.6-73.2) > 14 ngày |
C/S
97.0% (91.7-98.9) ≥7 ngày |
[29] | |||||
| Tử vong ở người 65+ sống ở nhà cần hỗ trợ | 21% 11-30)*
14 ngày đến liều thứ hai 2% (-54-37)** 14 ngày đến liều thứ hai |
70% (61-77)*
0-7 ngày Không ước tính cho tử vong liên quan đến COVID-19 ở ngày 0 – 7 62% (57-66)* >7 ngày 97% (88-99)** >7 ngày |
[23]^ | ||||
| Tử vong ở người 80+ | 40.3% (31.3-48.1)
0-14 ngày 56.6% (49.3-62.8) ≥14 ngày Đến 7 ngày sau liều thứ hai |
92,6% (90.6-94.1)
>7 ngày |
[18]^ | ||||
| 51% (47-62)
2-34 ngày |
[27] | ||||||
| Tử vong ở người 85+ | 50% (38-60)*
14 ngày đến liều thứ hai 15% (-822-86)** 14 ngày đến liều thứ hai |
80% (70-87)*
0-7 ngày 73% (66-79)* >7 ngày Không ước tính cho tử vong liên quan đến COVID-19 ở ngày 0 – 7 |
[23]^ | ||||
| Tử vong ở người nguy cơ COVID-19 nặng | 13% (1-25)*
14 ngày đến liều thứ hai 41% (-437-93)** 14 ngày đến liều thứ hai |
72% (60-80)*
0-7 ngày 46% (37-54)* >7 ngày Không ước tính cho tử vong liên quan đến COVID-19 ở ngày 0 – 7 |
[23]^ | ||||
| Tử vong ở tất cả các nhóm ưu tiên bao gồm cả nhân viên y tế tuyến đầu | 7% (-15-25) | 94% (90-96) | [23]^ | ||||
| 14 ngày đến liều thứ hai | >7 ngày | ||||||
S (Spikevax), C (Comirnaty), V (Vaxzeria). *All death, **COVID-19-related death. ^Preprint
1.2.3. Nhân viên y tế
Dữ liệu hiệu quả vaccine ở nhân viên y tế đến từ các nghiên cứu quan sát tại Đan Mạch [23,24], Anh Quốc [31,32], USA [33,34], Israel [35,36] và Ý [37]. Kết quả được tổng hợp trong Bảng 7.
Một nghiên cứu đoàn hệ tiến hành bởi Emberg và cs ở 440.748 nhân viên y tế Đan Mạch dựa trên cơ sở dữ liệu y tế, hiệu quả vaccine sau liều Comirnaty đầu tiên cho đến liều tiêm thứ hai là 16% (95% CI: 4−26) chống lại nhiễm SARS-CoV-2 và 18% (95% CI:-48−54) chống lại nhập viện liên quan đến COVID-19, tăng lên 80% (95% CI: 77−83) và 81% (95 CI%: 43−93), tương ứng sau liều tiêm thứ hai [23].
Trong một nghiên cứu thứ hai (nghiên cứu Danish) bởi Moustsen-Helm và cs (331.039 nhân viên y tế), hiệu quả chống nhiễm bệnh là 17% (95% CI: 4−28) 14 ngày sau liều thứ nhất và trước khi tiêm liều thứ hai. Hiệu quả vaccine sau 7 ngày tiêm liều thứ hai lên đến 90% (95% CI: 82−95) [24].
Một nghiên cứu quan sát thực hiện bởi Fabiani và cs ở 6.423 nhân viên y tế tại tỉnh Treviso, Ý cho thấy hiệu qủa vaccine chống lại nhiễm SARS-CoV-2 bất kỳ là 84% là 84% (95% CI: 40−96) 14–21 sau liều đầu tiên và 95% (95% CI: 62−99) ít nhất 7 ngày sau liều thứ hai [37].
Trong một nghiên cứu đoàn hệ thực hiện bởi Hall và cs ở nhân viên y tế tại dự án SARS-CoV-2 Immunity & Reinfection EvaluatioN (SIREN) ở Anh Quốc (23.000 nhân viên y tế được lấy xét nghiệm hàng tuần), liều đơn Comirnaty cho thấy hiệu quả vaccine là 72% (95% CI: 58−86) 21 ngày sau liều đầu tiên và 86% (95% CI: 76−97) 7 ngày sau liều thứ hai chống lại nhiễm SARS-CoV-2 bất kỳ. Tuy nhiên, cần chú ý rằng đoàn hệ đã được tiêm vaccine và theo dõi khi biến chủng lưu hành là biến chủng Alpha [32].
Một nghiên cứu quan sát đoàn hệ nhân viên y tế thực hiện bởi Lumley và cs tại Anh Quốc với mục tiêu đánh giá khả năng bảo vệ một hoặc hai liều Vaxzevria hoặc Comirnaty chống lại nhiễm bệnh có triệu chứng và không triệu chứng. So sánh với nhân viên y tế không tiêm khòng vaccine huyết thanh âm tính lên đến 42 ngày sau tiêm liều đầu tiên, liều đơn của Vaxzevria hoặc Comirnaty giảm tỷ lệ phát sinh nhiễm bệnh có triệu chứng là 67% (95% CI: 48−79) và nhiễm bệnh bất kỳ không triệu chứng là 64% (95% CI: 50−74). Tiêm hai liều vaccine hoặc huyết thanh dương tính (nhiễm bệnh từ trước) giảm tỷ lệ phát sinh kết quả xét nghiệm PCR dương tính bất kỳ có hoặc không có triệu chứng là 90% (95% CI: 62−98) là 85% (95% CI: 74−92), tương ứng [31].
Hiệu quả của Spikevax và Comirnaty được đánh giá trong một nghiên cứu đoàn hệ quan sát thực hiện bởi Thomson và cs ở nhân viên y tế, người đáp ứng liều đầu tiên và nhân viên y tế tuyến đầu tại Hoa Kỳ [33]. Hiệu quả của miễn dịch một phần chống lại nhiễm SARS-CoV-2 xác định bằng xét nghiệm PCR là 80% (95% CI: 59−90), đo từ ngày thứ 14 sau liều đầu đến khi tiêm liều thứ hai, trong khi miễn dịch đầy đủ với hai liều của một loại vaccine mRNA, hiệu quả là 90% (95% CI: 68−97). Các mức độ bảo vệ là tương đương với báo cáo bởi Pilishvili và cs (Xem bảng 7 ở dưới). [38].
Một nghiên cứu đoàn hệ lớn bởi Swift và cs ở nhân viên y tế tại US (xuất bản trước), hiệu quả của tiêm phòng vaccine một phần (từ ngày 14 sau liều đầu tiên đến ngày 14 sau liều thứ hai) với một trong hai loại vaccine mRNA( Comirnaty, Spikevax) chống lại nhiễm SARS-CoV-2 PCR dương tính bất kỳ là 78% và 96% sau tiêm liều đầy đủ (14 ngày sau liều thứ hai) [34]
Một nghiên cứu đoàn hệ hồi cứu thực hiện bởi Algel và cs tại Tel Aviv, Israel, bao gồm 6.710 nhân viên y tế, những người không được thực hện xét nghiệm nhiễm SARS-CoV-2 trước đó, tiêm phòng vaccine với hai liều Comirnaty có hiệu quả chống cả nhiễm bệnh có triệu chứng (VE điều chỉnh =98%; 95% CI: 93−100) và nhiễm bệnh không triệu chứng (VE điều chỉnh =91%; 95% CI: 75−97). Hiệu quả vaccine của một liều là không đáng kể cho nhiễm bệnh không triệu chứng nhưng có ý nghĩa, dù thấp hơn dự định, khi so sánh với hiệu quả sau hai liều chống lại nhiễm bệnh có triệu chứng [35].
Trong một nghiên cứu khác tại Israel bởi Tang và cs ở Jude Children’s Research Hospital, sàng lọc định kỳ nhân viên không triệu chứng và xét nghiệm mục tiêu cho những người có triệu chứng và người xác định phơi nhiễm được bắt đầu. Nghiên cứu cho thấy rằng vaccine liều đầu và trược liều thứ hai (trung bình khoảng cách giữa hai liều tiêm, 21 ngày [khoảng 11 – 49 ngày]), 75% (95% CI: -9−89) trong 0 – 7 ngày của liều thứ hai, và 90% (95% CI: 78−96) 7 ngày hoặc hơn sau liều thứ hai [36].
Bảng 7. Hiệu quả vaccine điều chỉnh [% (95% CI); thời gian sau tiêm] của một và hai liều chống lại COVID-19 (bất kỳ, không triệu chứng, có triệu chứng ở nhân viên y tế như được báo cáo trong xuất bản trước/nghiên cứu đã được chấp thuận (đến ngày 14 Tháng 6 năm 2021)
| Kết quả | Comirnaty | Spikevax | Phân tích tổng hợp nhiều sản phẩm | Tham khảo. | |||
| Liều 1 | Liều 2 | Liều 1 | Liều 2 | Liều 1 | Liều 2 | ||
| Nhiễm bệnh bất kỳ | 16% (4-26) đến liều thứ hai | 80% (77-83)
Từ 7 ngày sau liều thứ hai |
[23]^ | ||||
| 17% (4-28) 14 ngày | 90% (82-95)
Sau 7 ngày |
[24]^ | |||||
| 78% (71-82)
Hơn 14 ngày sau liều thứ nhất và dưới 14 ngày sau liều thứ hai |
96% (95-97)
Hơn 14 ngày sau liều tchứ hai |
91% (80-96)
Hơn 14 ngày sau liều thứ nhất và dưới 14 ngày sau liều thứ hai |
98% (90-99)
Hơn 14 ngày sau liều thứ hai |
[34]^ | |||
| 84% (40–96) 14–21
ngày |
95% (62–99)
ở ít nhất 7 ngày |
[37] | |||||
|
Nhiễm bệnh có triệu chứng |
C/S
80 (59-90) 14 ngày sau liều đầu tiên nhưng trước liều thứ hai |
C/S
90 (68-97) ≥14 ngày |
[33] | ||||
| C/S
81.7% (74.3–86.9) ≥14 ngày |
C/S
93.5% (86.5-96.9) ≥7 ngày |
[38] | |||||
| 83.3% (14.8-96.7)
14-21 ngày |
93.7% (50.8- 99.2)
≥7 ngày |
[37] | |||||
| C/S
67% (48-79) Lên đến 42 ngày sau tiêm vaccine |
C/S
90% (62-98) 14 ngày sau tiêm phòng thứ hai |
[31] | |||||
| 97% (91-99)
7-21 ngày sau liều đầu |
98% (93-100)
>7 ngày |
[35] | |||||
|
Nhiễm bệnh không triệu chứng |
C/S
64% (50-74) Lên đến 42 ngày sau tiêm vaccine |
C/S
85 (74-98) 14 ngày sau tiêm phòng thứ hai |
[31] | ||||
| 42% (-13-70) Trong vòng 21 ngày sau liều 1 | 90% (78-96)
≥7 ngày |
[36] | |||||
| 52% (-26 – 81)
7-21 ngày sau liều 1 |
91% (75-97)
>7 ngày |
[35] | |||||
| Nhập viện | 18% (-48-54) đến liều thứ hai | 81% (43-93) Hơn 7 ngày sau liều thứ hai | [23]^ | ||||
1.2.4. Hiệu quả vaccine chống lại các biến thể quan tâm (VOC)
Nhiều nghiên cứu đã chỉ ra rằng, dù huyết thanh của người hồi phục và người được tiêm phòng vaccine đã chứng minh giảm dung lượng trung hòa chống lại VOC, bao gồm biến thể Delta, khi so sánh với nguyên chủng, họ vẫn có hiệu quả trung hòa VOC trong in-vitro [39-41].
Một nghiên cứu đánh giá dung lượng trung hòa của huyết thanh lấy từ người đã được tiêm phòng vaccine 28 ngày sau khi nhận đủ hai liều BBV152 (Covaxxin, một loại vaccine virus bất hoạt được sản xuất bởi Bharat Biotech) (n=17), quan sát thấy giảm hiệu giá trung hòa 2.7 lần và 3.0 lần chống lại biến thể Delta và Beta, tương ứng, khi so sánh với biến thể B1 (D614G) [40]. Trong một nghiên cứu khác đánh giá dung lượng trung hòa sau sau một liều đơn của Vaxzevria, mức độ kháng thể trung hòa biến thể Delta và Beta thấp hơn đáng kể, khi so sánh với biến thể D.614G và Alpha [39]. 5 tuần sau liều Comirnaty thứ hai, giảm 3 lần và 16 lần hiệu giá trung hòa chống lại biến thể Delta và Beta, tương ứng, khi so sánh với biến Alpha.
Bằng chứng trên hiệu quả vaccine chống lại các biến thể đến từ nhiều nghiên cứu quan sát, hầu hết trong số chúng dựa trên thiết kết test âm tính, và cơ sở dữ liệu như các nguồn dữ liệu. Bảng 8 và Bảng 9 tổng hợp các kết quả của hiệu quả vaccine bởi hậu qủa, loại vaccine và biến thể.
Một nghiên cứu gần đây dựa trên cộng đồng thực hiện bởi Nasree và cs (xuất bản trước) tại Otanrio, Canada, sử dụng link tiêm phòng vaccine, xét nghiệm tại đơn vị xét nghiệm, chương trình y tế mở rộng báo cáo dữ liệu hiệu quả của Spikevax, Comirnaty và Vaxzevria chống lại nhiễm bệnh có triệu chứng và hậu quả bệnh nặng do biến thể [42]. Hiệu quả vaccine là cao hơn chống lại hậu quả bệnh nặng bất kỳ do biến thể Alpha. Sau tiêm phòng một phần, hậu quả bệnh nặng do biến thể bất kỳ nhìn chung cao hơn hiệu quả đã báo cáo nhiễm bệnh có triệu chứng, với bất kỳ loại vaccine nào được tiêm. Tiêm phòng đầy đủ đã được đánh giá 7 ngày sau liều thứ hai và hiệu quả tăng lên chống lại toàn bộ hậu quả, khi dữ liệu là sẵn có.
Một nghiên cứu thực hiện tại Anh bởi Bernal và cs (xuất bản trước) sử dụng thiết kế test âm tính báo cáo rằng hiệu quả vaccin chống lại nhiễm bệnh có triệu chứng với biến thể Delta sau một liều vaccine (21 ngày hoặc hơn sau liều đầu tiên đến trước ngày tiêm liều thứ hai) với Comirnaty hoặc Vaxzevria là 33%, đạt tới 88% và 61% sau liều thứ hai (sau liều thứ hai từ 14 ngày trở lên) của Comirnaty và Vaxxevria, tương ứng. Sau một liều vaccine Comirnaty hoặc Vaxzevria, hiệu quả chống lại nhiễm bệnh có triệu chứng với biến thể Delta giảm xấp xỉ 21% so với biến thể Alpha. Tuy nhiên, sau hai liều vaccine, giảm thấp hơn cho cả hai loại Comirnaty và Vaxzevria [43].
Một nghiên cứu đoàn hệ thực hiện bởi Sheik và cs tại Scotland từ 1 Tháng tư đến 6 Tháng 6 năm 2021, quan sát rằng tiêm đầy đủ cả Comirnaty và Vaxzevria (ít nhất 28 ngày sau liều thứ hai) có hiệu quả giảm nguy cơ nhiễm SARS-CoV-2, trong khi hiệu quả của một liều (ít nhất 28 ngày sau liều đầu tiên) là thấp hơn đáng kể ở cả hai loại vaccine. Ảnh hưởng của tiêm đầy đủ cho cả hai loại vaccine trên nhiễm chủng Delta thấp hơn khi so sánh với biến thể Alpha [44].
Một nghiên cứu đối chứng ca bệnh test âm tính thực hiện bởi Abu-Raddad tại Quatar ước tính rằng hiệu quả vaccine của một liều Comirnaty chống lại bất kỳ nhiễm bệnh nào được ghi nhận với biến thể Delta là thấp (16.9%; 95% CI: 10.4- 23.0), đạt tới 75.0% (95% CI: 70.5−78.9) 14 ngày hoặc hơn sau liều thứ hai [45]. Hiệu quả ước tính chống lại bất kỳ nhiễm bệnh nào được ghi nhận với biến thể Alpha là 29.5% (95% CI: 22.9−35.5) sau liều đầu tiên và 89.5% (95% CI: 85.9−92.3) 14 ngày hoặc hơn sau liều thứ hai. Hiệu quả vaccine tổng hwpj chống lại bệnh nặng, nguy kịch, tử vong do bất kỳ biến thể SARS-CoV-2 nào (Alpha hoặc Beta) là rất cao sau liều thứ hai (97.4%; 95% CI: 92.2−99.5) so sánh với 39.4% (95% CI: 24.0−51.8) sau liều đầu tiên.
Với hai liều, ước tính trên theo cùng một xu hướng như báo cáo bởi Stowe và cs theo dõi định kỳ hiệu quả ở Anh Quốc (xuất bản trước): Hiệu quả vaccine chống lại nhập viện với biến thể Delta là tương tự như với biến thể Alpha: 94% (46−99) và 96% (86−99) sau liều đầu và liều thứ hai của vaccine Comirnaty tương ứng; 71% (51−83) và 92% (75−97) sau liều đầu và liều thứ hai của vaccine Vaxzevria tương ứng [46].
Trong một nghiên cứu xuất bản trước bởi Chung và cs tại Ontario, Canada, hai liều vaccine mRNA (Comirnaty hoặc Spikevax) cho thấy hiệu quả cao hơn chống lại cả nhiễm bệnh có triệu chứng và hâu quả bệnh nặng do biến thể Alpha là (91%, 95% CI: 89-93) và (98%, 95% CI: 88−100) tương ứng. Hiệu quả của một liều thấp hơn khi so sánh với hai liều và tăng từ 48% (95% CI, 41−54%) ở ngày 14 đến 20 đạt tới đỉnh là 71% (95% CI: 63–78%) ở ngày thứ 31 đến ngày thứ 41 [47].
Ở phân nhóm những người ở độ tuổi 70+ (loại trừ người LTCF) bởi Chung và cs, hiệu quả vaccine chống lại nhiễm bệnh có triệu chứng do biến thể Alpha tăng từ 24% (95% CI: 7−38) từ ngày 21 đến ngày thứu 27 sau tiêm lên đến 85% (95% CI: 38−97) ở ngày 42 đến ngày thứ 48. Hiệu quả của một liều bảo vệ chống lại bệnh nặng do biến thể Alpha tằng từ 58% (95% CI: 35−72) ở ngày 14 đến ngày lên 93% (95% CI:71−98) từ ngày 35 trở đi [47]. Mức độ bảo vệ của liều thứ hai (>=7 ngày) là 94 (95% CI: 87−97) và 97 (95% CI: 86−99) tương ứng chống lại nhiễm bệnh có triệu chứng và hậu quả bệnh nặng.
Ước tính từ Skoeronski và cs (xuất bản trước) từ nghiên cứu đối chứng ca bệnh ở người 70+ cho thấy rằng hiệu quả vaccine chống lại nhiễm bệnh bất kỳ do không biến thể, Beta, Gamma là tương ứng 72% (95% CI: 58−81), 67% (95% CI: 57−75) và 61% (95% CI: 45−72) sau 21 ngày hoặc hơn sau tiêm [48].
Table 8. Hiệu quả vaccine điều chỉnh [% (95% CI); thời gian sau tiêm] của một và hai liều chống lại niễm COVID-19 (bất kỳ hoặc có triêu chứng do bất kỳ biến thể Alpha, Beta, Gamma and Delta VOCs như đã được báo cáo trong nghiên cứu xuất bản trước/nghiên cứu đã được chấp thuận đến 14 Tháng 6 năm 2021
| Biến thể
|
Spikevax | Comirnaty | Vaxzeria | Phân tích tổng hợp cho nhiều sản phẩm | Tham khảo | ||||
| Liều 1 | Liều 2 | Liều 1 | Liều 2 | Liều 1 | Liều 2 | Liều 1 | Liều 2 | ||
| Không biến thể | SI
54% (28-70) ≥14 ngày |
SI
89% (65-96) ≥7 ngày |
SI
61% (54-68) ≥14 ngày |
SI
93% (86-96) ≥7 ngày |
SI
67% (38-82) ≥14 ngày |
[42]#^ | |||
| S/C AI
72% (58-81) ≥21 ngày |
[48] | ||||||||
| Alpha | SI
83% (80-86) ≥14 ngày |
SI
92% (86-96) ≥7 ngày |
SI
66% (64-68) ≥14 ngày |
SI
89% (86-91) ≥7 ngày |
SI
64% (60-68) ≥14 ngày |
[42]^ | |||
| C
|
SI
49.2% (42.6- 55.0) ≥21 sau liều 2 |
SI
93.4% (90.4- 95.5) ≥14 ngày |
SI
51.4% (47.3- 55.3) ≥21 đến liều 2 |
SI
66.1% (54.0-75.0) ≥14 ngày |
C/V
SI 51.1% (47.3-57.7) ≥21 đến liều 2 |
SI
86.8% (83.1-89.6) ≥14 ngày |
[43]^ | ||
| SI
27% (13-39) AI 38% (29-45) ở ít nhất 28 ngày sau liều 1 |
SI
92% (88-94) AI 92%, (90- 93) ở ít nhất 28 ngày sau liều 1 |
SI
39%, (32- 45) AI 37 (32-42) ở ít nhất 28 ngày sau liều 1 |
SI
81% (72-87) AI 73% (66-78) ở ít nhất 28 ngày sau liều 2 |
SI
92% (90-93) ở ít nhất 28 ngày sau liều 2 |
[44] | ||||
| AI* 29.5% (22.9-
35.5) |
AI* 89.5% (85.9-
92.3) ≥14 ngày |
[45] | |||||||
| S/C SI | S/C SI | [47] | |||||||
| 60% (57-64) | 91% (89-93) | ||||||||
| ≥14 ngày | ≥7 ngày | ||||||||
| S/C AI | [48]^ | ||||||||
| 67% (57-75) | |||||||||
| ≥21 ngày | |||||||||
| Beta | AI
16.9% |
AI
75.0% |
[45] | ||||||
| (10.4-23.0) | (70.5-78.9)
≥14 ngày |
||||||||
| Beta/Gamma | SI
77% (63-86) ≥14 ngày |
SI
60% (52-67) ≥14 ngày |
SI
84% (69-92) ≥7 ngày |
SI
48% (28-63) ≥14 ngày |
[42]^ | ||||
| Gamma | S/C AI
61% (45-72) ≥21 ngày |
[48]^ | |||||||
| Delta | SI
72% (57- 82) ≥14 ngày |
SI
56% (45-64) ≥14 ngày |
SI
87% (64-95) ≥7 ngày |
SI
67% (44-80) ≥14 ngày |
[42]^ | ||||
| SI
33.2% (8.3- 51.4) ≥21 đến liều thứ hai |
SI
87.9% (78.2- 93.2) ≥14 ngày |
SI
32.9% (19.3- 44.3) ≥21 đến liều thứ hai |
SI
59.8% (28.9- 77.3) ≥14 ngày |
C/V SI
33.5% (20.6-44.3) ≥21 đến liều thứ hai |
C/V SI
80.9% (70.7- 87.6) ≥14 ngày |
[43] | |||
| SI
33% (15-47) AI 30% (17-41) ít nhất 28 ngày sau liều 1 |
SI
83% (78-87) AI 79% (75-82) ít nhất 28 ngày sau liều 2 |
SI
33% (23-41) AI 18% (9-25) ít nhất 28 ngày sau liều 1 |
SI
61% (51-70) AI 60% (53-66) ít nhất 28 ngày sau liều 2 |
C/V SI
79% (75-82) ít nhất 28 ngày sau liều 2 |
[44] | ||||
S (Spikevax), C (Comirnaty), V (Vaxzeria), NE (no estimate), SI (Symptomatic infection), AI (any infection). ^Preprint # Non-VOC specimens with no lineage information and N501Y-/E484K- specimens collected prior to 1 April 2021.& Non-VOC: Whole Genom Sequencing=non-VOC or Screening RT-PCR=Negative for N501Y (presumptive) *In ≥70 years old.
Bảng 9. Hiệu quả vaccine điều chỉnh [% (95% CI); thời gian sau tiêm] của một và hai liều chống lại nhiễm COVID-19 nặng do bất kỳ biến thể Alpha, Beta, Gamma and Delta như đã được báo cáo trong nghiên cứu xuất bản trước/nghiên cứu đã được chấp thuận đến 14 Tháng 6 năm 2021
| Biến thể | Spikevax | Comirnaty | Vaxzeria | Phân tích tổng hợp cho nhiều vaccine | Tham khảo | |||||
| Liều 1 | Liều 2 | Liều 1 | Liều 2 | Liều 1 | Liều 2 | Liều 1 | Liều 2 | |||
| Non- VOC | H/D
57% (28-75) ≥14 ngày |
H/D
96% (70-99) ≥7 ngày |
H/D
68% (54-78) ≥14 ngày |
H/D
96% (82-99) ≥7 ngày |
[42]#^ | |||||
| Alpha | H/D
79% (74- 83) ≥14 ngày |
H or D
94% (89-97) ≥7 ngày |
H/D
80% (78- 82) ≥14 ngày |
H/D
95% (92-97) ≥7 ngày |
H/D
85% (81-88) ≥14 ngày |
[42]^ | ||||
| H/D
54.1% (26.1- 71.9)* |
H/D
(81.7- 100) ≥14 ngày* |
[45] | ||||||||
| H
83% (62- 93) |
H
95% (78- 99) |
H
76% (61- 85) |
H
86% (53- 96) |
C/V
H 78% (65-86) |
C/V
H 92% (78-97) |
[46]^ | ||||
| S/C H/D
70% (60-77) ≥14 ngày |
S/C H/D
98% (88-100) ≥7 ngày |
[47] ^ | ||||||||
| H/D
0.0% (0.0- 19.0)* Unknown |
H/D
100% (73.7- 100) ≥14 ngày* |
[45] | ||||||||
| Beta
|
||||||||||
|
Alpha/ Beta |
H/D
39.4% (24.0-51.8)* |
H/D
97.4% (92.2- 99.5) ≥14 ngày* |
[45] | |||||||
| Gamma | H/D
89% (73- 95) ≥14 ngày |
H/D
77% (69- 83) ≥14 ngày |
H/D
95% (81-99) ≥7 ngày |
H/D
83% (66- 92) ≥14 ngày |
[42]^ | |||||
| Delta | H/D
96% (72- 99) ≥14 ngày |
H/D
78% (65- 86) ≥14 ngày |
H/D
88% (60- 96) ≥14 ngày |
[42] | ||||||
| H
94% (46- 99) |
H
96% (86- 99) |
H
71% (51- 83) |
H
92% (75- 97) |
[46]^ | ||||||
S (Spikevax), C (Comirnaty), V (Vaxzeria). H (Hospitalisation) D (Death). ^Preprint. * Severe, critical, or fatal disease; # Non-VOC specimens with no lineage information and N501Y-/E484K- specimens collected prior to 1 April 2021.
1.3. Tổng hợp bằng chứng và khoảng trống chưa biết
Dữ liệu có sẵn, qua các nhóm cộng đồng khác nhau và các biến thể quan tâm (VOCs), xác nhận rằng khả năng bảo vệ chống lại nhiễm bệnh không triệu chứng và có triệu chứng và các hậu quả nặng của bệnh đại diện bởi hai liều vaccine (Comirnaty, Spikevax, và Vaxzevria) là cao hơn tiêm phòng một lần (một liều trong phác đồ hai liều). Hiệu quả của liều đơn có xu hướng tăng lên theo thời gian sau tiêm, nhưng bằng chứng hiệu qủa kéo dài bị hạn chế.
Các nghiên cứu quan sát thực hiện trong cộng đồng chung dựa trên đoàn hệ lớn và các thiết lập khác nhau. Các nghiên cứu đó cho thấy các kết quả tương đương ở mục tiêu hiệu quả vaccine là lớn hơn của hoàn thành hai liều tiêm vaccin chống lại nhiễm bệnh không triệu chứng và có triêu chứng và các hậu quả nặng của bệnh, bao gồm nhập viện và tử vong, so sánh với tiêm phòng vaccine một phần [14,21]. Hiệu quả chống lại nhiễm bệnh không triệu chứng đã được báo cáo, là một khía cạnh quan trọng cho kiểm soát sự tuần hoàn của virus [19]. Các kết quả đó rút ra từ thiết lập đời sống thực đã xác nhận các phát hiện trước đây trên hiệu quả vaccine ở các thử nghiệm đối chứng ngẫu nhiên đối với Comirnaty, Spikevax, và Vaxzevria. Hầu hết các nghiên cứu quan sát được tiến hành ở giai đoạn bắt đầu của chiến dịch tiêm phòng vaccine COVID-19, cũng như một số nước chỉ ưu tiên vaccine mRNA, hầu hết dữ liệu tham khảo đến từ loại vaccine này (chủ yếu là Comirnaty).
Nhiều nghiên cứu quan sát được tiến hành ở người thuộc nhóm ưu tiên ban đầu bởi chiến dịch quốc gia do nguy cơ cao của hậu quả bệnh SARS-CoV-2 nặng của họ (như người cao tuổi, người LTCF) hoặc người phơi nhiễm (nhân viên y tế). Các nghiên cứu đó xác nhận tính ưu việt của hoàn thành hai liều vaccine vượt trội hơn hẳn tiêm một liều ở các chỉ tiêu lâm sáng chính gồm bảo vệ chống lại nhiễm bệnh SARS-CoV-2, nhập viện và tử vong. Tuy nhiên, điều thú vị là hiệu quả dường như khá thay đổi, một số trường hợp hiệu quả thấp hơn trong cộng đồng chung. Xét toàn diện, dữ liệu lấy từ các nghiên cứu quan sát thực hiện ở nhân viên y tế và nhân viên tuyến đầu khác cung cấp kết quả tương tự với kết quả với người từ thử nghiệm ngẫu nhiên trong giai đoạn sớm của thử nghiệm ở hầu hết các nước và dữ liệu sống thực cho thấy hoàn thành tiêm phòng hai liều đảm bảo khả năng bảo vệ cao hơn chống lại nhiễm bệnh không triệu chứng và có triệu chứng so với tiêm phòng một phần.
Dữ liệu hiệu quả vaccine sẵn có trên tiêm phòng một phần và đầy đủ chống lại các hậu quả khác nhau và biến thể khác nhau cho thấy rằng mức độ bảo vệ của một liều thay đổi phụ thuộc vào chế phẩm vaccine, kết qủa nghiên cứu (không triệu chứng, có triệu chứng và bệnh nặng, bao gồm nhập viện và tử vong) và biến thể với tính hiệu quả đã được kiểm chứng (Alpha, Beta/Gamma và Delta). Bằng chứng có sẵn chỉ ra rằng những người được tiêm phòng vaccine một phần có khả năng bảo vệ thấp hơn chống lại nhiễm trùng có triệu chứng trước biến thể Delta so với biến thể Alpha, bất kể loại vaccine nào. Tuy nhiên, hiệu quả của phác đồ hai liều là cao hơn hẳn tiêm phòng vaccine một liều qua từng hậu quả và biến thể. Và nó gần như bằng nhau đối với cả biến thể Delta và Alpha.
Nhìn chung, hiệu quả ước tính của tiêm phòng vaccine một phần dường như bị tác động lớn bởi thời gian sau tiêm hoặc khoảng cách thời gian được sử dụng để phân tích, và nhìn chung là tăng theo thời gian. Tuy nhiên, bằng chứng của hiệu quả kéo dài của tiêm phòng vaccine một phần là hạn chế bởi thực tế rằng liều thứ hai được tiêm chỉ sau một vài tuần. Phân tích xa hơn của hiệu quả vacicine một phần cho các hậu quả khác nhau, chế phẩm vaccine khác nhau, cộng đồng khác nhau và biến chủng khác nhau với thời gian theo dõi lâu hơn giữa liều đầu tiên và liều thứ hai có thể cung cấp bằng chứng ưu điểm có khả năng của liều thứ hai chậm lại trong các tình huống đặc biệt.
Có nhiều hạn chế liên quan đến các nghiên cứu quan sát. Khi mà vaccine được thúc đẩy, với các loại vaccine khác nhau đã được tiêm và các cộng đồng khác nhau được đăng ký theo thời gian dựa trên thực hiện theo giai đoạn và các chiến lược ưu tiên, các nghiên cứu có thể khác nhau ở đặc điểm cộng đồng, các chế phẩm được sử dụng và sự tuần hoàn của các biến thể. Điều này có thể ảnh hưởng đến ước tính hiệu qủa chống lại hậu quả đặc biệt. Ngoài ra, các định nghĩa khác nhau được sử dụng để xác định và ước tính hiệu quả vaccine của tiêm phòng một phần hoặc đầy đủ trong thuật ngữ này tính từ khi tiêm và khoảng cách đánh giá các hậu quả. Phương pháp lấy mẫu xét nghiệm (tự lấy mẫu, lấy mẫu hệ thống, lấy mẫu theo triệu chứng) cũng thay đổi qua từng nghiên cứu có thể ảnh hướng đến tính đồng bộ. Với một số nghiên cứu, tiến hành khi bắt đầu chiến dịch tiêm phòng vaccine, dữ liệu hiệu quả của liều tiêm thứ hai là thiếu bởi thời gian theo dõi quá ngắn.
Cuối cùng, các nghiên cứu quan sát là phương pháp có nhiều yếu tố gây nhiễu và các vấn đề sai sót trong phân loại mà có thể gây ra trong mối liên quan đến kết quả, phơi nhiễm (được tiêm vaccine), và đặc tính virus cho những nghiên cứu đó đánh giá tính hiệu quả chống lại các biến thể.
2. Tiêm phòng vaccine cho người đã bị nhiễm từ trước
Trong bốn loại vaccine hiện nay được cấp phép cho sử dụng tại EU/EAA, ba loại trong số chúng có phác đồ hai liều: Comirnaty, Spikevax, Vaxzevria. Đối với những đối tượng hồi phục sau nhiễm SARS-CoV-2 từ trước, một số nghiên cứu chỉ ra rằng liều đơn Comirnaty, Spikevax, Vaxzevria sinh kháng thể và đáp ứng miễn dịch tế bào là có thể so sánh – trong thời gian ngắn – với những đối tượng hoàn thành hai liều tiêm. Tuy nhiên, không có bằng chứng sẵn có về các điểm cuối lâm sàng, như nguy cơ nhiễm bệnh xác định bằng xét nghiệm và bệnh có triệu chứng, cho các đối tượng đã bị nhiễm bệnh từ trước chỉ cần một liều vaccine của loại vaccine hai liều.
2.1. Dữ liệu từ các thử nghiệm đối chứng ngẫu nhiên
Ở các kết quả của các thử nghiệm lâm sàng đã công bố đối với Comirnaty, không có dữ liệu sẵn có trên hiệu quả ở người đã bị nhiễm bệnh từ trước [49,50]. Đối với vaccine COVID-19 Spikevax và Vaxzevria, dữ liệu từ các thử nghiệm lâm sàng là không đủ để đánh giá hiệu quả vaccine ở đối tượng có bằng chứng nhiễm bệnh SARS-CoV-2 từ trước [1].
2.2. Dữ liệu từ nghiên cứu quan sát
Dữ liêu đã xuất bản từ trước và được chấp thuận trên đáp ứng miễn dịch ở những đối tượng đã bị nhiễm bệnh từ trước đã được tiêm một liều vaccin phần lớn được lấy ra từ các nghiên cứu đoàn hệ ở nhân viên y tế với một thời gian dài, với tâm điểm của các công bố là trên vaccine mRNA Comirnaty và Spikevax.
Đối với Comirnaty, nhiều nghiên cứu đã chứng minh rằng những người đã bị nhiễm từ trước hình thành hiệu giá kháng thể đáng kể của kháng thể kháng spike huyết thanh sau khi tạo miễn dịch bằng một liều đơn, khi so sánh với những người nhận được một liều [51-57]. Xa hơn, dung lượng kháng thể huyết thanh hình thành sau liều đơn ở người đã bị nhiễm bệnh từ trước, để trung hòa biến thể Alpha, Beta, và Gamma in vitro là có thể so sánh với dung lượng trung hòa của kháng thể huyết thanh lấy từ người hoàn thành hai liều tiêm [51, 52, 58].
Trong một nghiên cứu xuất bản từ trước, Angyal và cs dùng nghiên cứu đoàn hệ quan sát, đa trung tâm, tiến cứu ở nhân viên y tế tuyển chọn tạo UK PITCH (Miễn dịch Bảo vệ từ Tế bào T với COVID-19 ở Nhân viện Y tế) để so sánh với những người dùng một liều (n=216) hoặc hai liều (n=21) Comirnaty, đánh giá 28 ngày sau tiêm phòng. Đáp ứng tế bảo T cao hơn 6 lần ở người nhiễm bệnh từ trước khi tiêm một liều Comirnaty so với người nhận được một liều, tiêm phòng vaccine cải thiện mức độ đáo ứng tế bào T đã tạo ra cả về số lượng và chất lượng ở người đã bị nhiễm bệnh từ trước. Đáp ứng tế bào T ở người nhiễm bệnh từ trước tiêm một liều Comirnaty là cân bằng với người tiêm hai liều Comirnaty. Hiệu giá kháng thể IgG kháng spike sau một liều tiêm ở người nhiễm bệnh từ trước cao hơn 6 – 8 lần so với người tiêm một liều, và 2.9 lần so với người tiêm hai liều sau 3 tuần. Cuối cùng, nghiên cứu so sánh đáp ứng kháng thể sau tiêm vaccine với protein spike đại diện là biến thể D614G và Alpha, Beta, và Gamma ở phân nhóm không nhiễm và đối tượng nhiễm bệnh từ trước sử dụng xét nghiệm trung hòa thay thế, dựa trên biến mất hoàn toàn đối với dắn ACE2 với spike. Một liều Comirnaty tạo ra hiệu giá trung hòa cao hơn đáng kể ở người đã bị nhiễm từ trước so với nhân viên y tế chưa nhiễm bệnh.
Các nghiên cứu quan sát điều tra phác đồ một liều cho người đã bị nhiễm từ trước đánh giá đáp ứng miễn dịch ở đoàn hệ tiêm vaccin mRNA Comirnaty hoặc Spikevax, không có phân tích phân biệt các thương hiệu vaccine khác nhau. Ở nghiên cứu đó, người bị nhiễm bệnh từ trước hình thành hiệu giá kháng thể kháng spike cao hơn sau một liều vaccine mRNA, khi so sánh với người chưa bị nhiễm tiêm một liều vaccine mRNA [59-62].
Krammer và cs [63] sử dụng mẫu chuyển đổi huyết thanh từ nghiên cứu đoàn hệ US PARIS (Khả năng Bảo vệ Liên quan đến Đáp ứng Miễn dịch Nhanh với SARS-CoV-2). Trong 110 người tiêm một liều Comirnaty hoặc Spikevax, 67 người huyết thanh âm tính và 43 người huyết thanh dương tính trước khi tiêm phòng vaccine. Người huyết thành dương tính hình thành đáp ứng kháng thể sớm hơn (trong vòng 4 ngày) và hiệu giá kháng thể đầy đủ lên đến 27 ngày khi so sánh với người huyết thanh âm tính. Hiệu giá kháng thể của người đã được tiêm phòng với miễn dịch đã có từ trước cao hơn 10 đến 45 lần người được tiêm phòng mà không có miễn dịch từ trước ở toàn bộ các điểm thời gian sau khi tiêm một liều đầu tiên. Tuy nhiên, hiệu giá đó vượt xa với hiệu giá trung bình đo được ở người không có miễn dịch từ trước sau liều thứ hai bằng một yếu tố là 6. Dù hiệu giá kháng thể của người không có miễn dịch trước tăng bằng yếu tố là 3 sau liều vaccine thứ hai, không thấy tăng hiệu giá kháng thể ở người hồi phục COVID-19 nhận được liều tiêm thứ hai. Các tác giả thực hiện phân tích chia theo thương hiệu vaccine, không thấy có sự khác biệt nào trong động lực học đáp ứng kháng thể nào gợi ý là Comirnaty hay Spikevax sau liều vaccine đầu tiên.
Saadat và cs [61] đánh giá đáp ứng kháng thể ở ngày 0, 7 và 14 sau tiêm một liều vaccine Comirnaty hoặc Spikevax tại đoàn hệ nhân viên y tế US. Trong 59 người, 17 không bị nhiễm SARS-CoV-2 từ trước, trong khi đó, 16 người nhiễm bệnh không triệu chứng, 26 người nhiễm bệnh có triệu chứng từ trước. Đáp ứng kháng thể ở ngày 7 quan sát duy nhất ở người đã nhiễm từ trước, với đáp ứng cân bằng, không phân biệt triệu chứng. Ở ngày thứ 14, nhân viên y tế bị nhiễm từ trước cho thấy mức độ kháng thể cao hơn đáng kể so với người chưa bị nhiễm, với đáp ứng cân bằng ở đối tượng có triệu chứng và không triệu chứng.
Dù nhiều nghiên cứu đã chứng minh đáp ứng huyết thanh học mạnh mẽ với một liều vaccine mRNA ở người đã nhiễm bệnh từ trước, các nghiên cứu đánh giá đáp ứng huyết thanh học sau một liều vaccine adenovector Vaxzevria khá hạn chế. Trong một nghiên cứu xuất bản trước từ nhân viên y tế Swedish, Havervall và cs [64] so sánh kháng thể IgG kháng spike và trung hòa spike – ACE2 chống SARS-CoV-2 với loại bất kỳ và biến thể Alpha, Beta và Gamma sau liều Comirnaty thứ hai và một liều Vaxzevria ở 232 nhân viên y tế có hoặc không có nhiễm bệnh COVID-19 từ trước. Mức độ kháng thể IgG kháng spike và kháng thể trung hòa sau tiêm vaccine chông SARS-CoV-2 loại bất kỳ và toàn bộ ba biến thể là tương đương hoặc cao hơn ở những người tiêm một liều Vaxzeria sau nhiễm SARS-CoV-2 (cả dưới 11 Tháng sau nhiễm bệnh (n=37) và trên 11 Tháng sau nhiễm bệnh (n=46)) so sánh với người nhạn được hai liều vaccine Comirnaty (n=149).
Nghiên cứu thêm bởi Tut và cs [58], trong một nghiên cứu xuất bản từ trước, tâm điểm thực hiện của nhiễm bệnh từ trước trên đáp ứng dịch thể và tế bào dau tiêm một liều Comirnaty hoặc Vaxzevria. Trong 89 nhân viên và 35 người LTCF, 20% nhân viên và 34% người LTCF có bằng chứng nhiễm bệnh từ trước. Ở người chưa nhiễm LTCF, đáp ứng kháng thể IgG kháng spike hình thành chậm hơn ở nhân viên trẻ hơn sau một liều, với đáp ứng khá nghèo nàn ở 21 ngày đầu tiên. Không có sự khác biện nào quan sát được giữa các nhóm tuổi ở 22 – 42 ngày hoặc 42 ngày trở lên sau tiêm một liều. Tuy nhiên, ở người LTCF nhiễn bệnh từ trước, sản sinh kháng thể là nhanh, xảy ra trong vòng 21 ngày ở toàn bộ đối tượng nghiên cứu, bất kể tuổi. Tiêm vaccine một liều ở người chưa nhiễm bệnh sản sinh kháng thể mà được cung cấp chỉ ở mức độ trung bình của ức chế gắn kế Spike-ACE2 đối với biến thể Alpha, Beta và Gamma, trong khi ức chế là cao hơn đáng kể đối với người bị nhiễm bệnh từ trước nhân được một liều vaccine. Đáp ứng miễn dịch tế bào sau tiêm vaccine, như được xác định bởi số lượng tế bào máu đơn nhân ngoại vi (PBMC), INF-gamma, tế bào T ELISpot, là khiêm tốn nhất ở người không nhiễm bệnh từ trước và phát hiện ở 45% người dưới 65 tuổi và 44% người trên 65 tuổi. Tương phan, đáp ứng miễn dịch tế bào được phát hiện ở 100% người có tiền sử nhiễm bệnh từ trước nhận được một liều vaccine, và ở mức độ lớn hơn, không có sự khác biệt giữa các nhóm tuổi. Dù người tiêm một liều vaccine Comirnaty hoặc Vaxzevria trong nghiên cứu, các tác giả quan sát thấy không có sự khác biệt thống kê ở đáp ứng miễn dịch giữa hai loại vaccine.
Dữ liệu thế giới trên đáp ứng kháng thể sau tiêm phòng vaccine ở cộng đồng chung là hạn chế. Tuy nhiên, nghiên cứu chuyển đổi huyết thanh đã xuất bản từ trước của 45.965 người lớn tuyển chọn ở UK’s national COVID-19 Infection Survey, 3.767 (8.2%) và 2.067 (4.5%) đối tượng nhiễm bệnh từ trước nhận được một liều Vaxzevria hoặc Comirnaty, tương ứng. Tổng số, 23.368 (50.8%), 14.894 (32.4%) và 1.869 (4.1%) đối tượng không có bằng chứng nhiễm bệnh từ trước tiêm một liều Vaxzevria, một liều Comirnaty, và hai liều Comirnaty, tương ứng. Ở người không có bằng chứng nhiễm bệnh từ tước, đối tượng cao tuổi hơn có đáp ứng kháng thể IgG kháng spike thấp hơn đối tượng trẻ tuổi hơn sau khi nhận được một liều vaccine, đặc biệt ảnh hưởng rõ rệt ở người trên 60 tuổi. Hai liều vaccine trong phác đồ tiêm phòng mồi – tăng cường đạt được đáp ứng ở toàn bộ các nhóm. Đặc biệt là ở những người có bằng chứng nhiễm bệnh từ trước, với tỷ lệ cao hơn (94%)ở những đối tượng đạt được đáp ứng kháng thể dương tính 28 ngày sau tiêm phòng, bất kể độ tuổi và loại vaccine, tương tự với tỷ lệ dương tính ở những đối tượng không có nhiễm bệnh từ trước nhận được hai liều Comirnaty. Tuy nhiên, tác giả nhấn mạnh cần có dữ liệu hiệu quả vaccine chống lại các hậu quả lâm sàng, đưa ra mối tương quan không hoàn toàn giữa khả năng bảo vệ khỏi nhiễm trùng và sự chuyển đổi huyết thanh [65].
2.3. Tổng hợp bằng chứng và khoảng trống chưa biết
Dữ liệu đã xuất bản từ trước và dữ liệu được chấp nhận trên đáp ứng miễn dịch ở người nhiễm bệnh trước đây tiêm một liều vaccine được lấy ra chủ yếu từ các nghiên cứu đoàn hệ ở nhân viên y tế. Các nghiên cứu một liều Comirnaty, Spikevax và Vaxzevria cho các đối tượng đã bị nhiễm bệnh từ trước chỉ ra đáp ứng miễn dịch dịch thể và tế bào là so sánh được với người chưa từng bị nhiễm hoàn thành tiêm hai liều vaccine. Tuy nhiên, đánh giá miễn dịch học ở các nghiên cứu đó thường diễn ra trong khoảng từ 1 đến 4 tuần sau tiêm một liều vaccine, và dữ liệu là hiếm ở cho việc so sánh khả năng miễn dịch kéo dài đối với cá nhân không nhiễm bệnh hoàn thành hai liều tiêm [66]. Dù kháng thể huyết thanh được hoàn thành sau một liều ở người nhiễm bệnh từ trước đã được chỉ ra là trung hòa biến thể Alpha, Beta, và Gamma in vitro, dữ liệu trung hòa cho biến thể Delta còn thiếu. Trong sự vắng mặt của hình thái so sánh lấy ra từ các thiết lập bắt nguồn từ người nhiễm bệnh từ trước, và nhiễm COVID-19 ở mức độ nặng khác nhau, chú ý thực hành trong chuyển đổi tính sinh miễn dịch để phòng ngừa các mức độ bệnh COVID-19. Không có bằng chứng hiện nay trên các điểm cuối lâm sàng, như nguy cơ nhiễm bệnh xác định bằng xét nghiệm và bệnh có triệu chứng ở người đã nhiễm bệnh từ trước nhận được chỉ một liều tiêm vaccine (từ loại cho phác đồ hai liều). Trong bối cảnh thiếu bằng chứng lâm sàng hiện nay cho các điểm cuối lâm sàng và thời gian đáp ứng miễn dịch sản sinh nhỏ phác đồ một liều ở người nhiễm bệnh từ trước, khi mà chú ý ở nhiều nước vẫn tiếp tục tiêm liều thứ hai, mỗi cơ quan EMA, đặc biệt cho người cao tuổi và người có nguy cơ hậu quả bệnh nặng sau nhiễm SARS-CoV-2, và với mức độ suy giảm kháng thể và tế bào nhớ nhanh hơn.
3. Các phác đồ tiêm phòng dị hợp
Các phác đồ tiêm phòng vaccine mồi – tăng cường (prime – boost) khác nhau, còn được gọi là “hỗn hợp – phù hợp” (“mix-and-match”), gồm sử dụng các loại vaccine khác nhau để mồi (liều đầu tiên) và tăng cường (liều thứ hai), đáp ứng miễn dịch đặc hiệu vi sinh vật hoặc kháng nghuyên. Các phác đồ mồi – tăng cường khác nhau đã được nghiên cứu từ trước, dù hầu hết là ở động vật thực nghiệm và nghiên cứu tiền lâm sàng, cho người nhiễm HIV, viêm gan do virus, lao và sốt rét [68]. Gần đây, các phác đồ dị hợp, các phác đồ tiêm phòng vaccine papillomavirus ở người (HPV) [69] và Ebola virus [69] đã được chứng minh là tạo miễn dịch và an toàn trong các thử nghiệm lâm sàng.
Trong trường hợp COVID-19, một đáp ứng miễn dịch có thể kỳ vọng từ phối hợp các loại vaccine COVID-19 khác nhau, khi mà toàn bộ các loại vaccine được cho phép đã đưa ra một khả năng đáp ứng miễn dịch chống lại protein gai của SARS-CoV-2, và vaccine hỗn hợp có khả năng tăng cường đáp ứng miễn dịch [71]. Các nghiên cứu sơ bộ trên các chiến lược mồi – tăng cường (như, phối hợp mRNA và vaccin adenovirrus vector) đã được thực hiện trên mô hình động vật và chỉ ra tính sinh miễn dịch tốt cho cả đáp ứng dịch thể và tế bào [72,73].
Đến Tháng 5 năm 2021, sau điều tra của Ủy ban Đánh giá Nguy cơ Dược phẩm (PRAC) và Ủy ban Sản xuất Y tế Sử dụng trên Người (CHMP) thấy rằng các biến cố hội chứng đông máu có giảm tiểu cầu (TTS) là rất hiếm sau tiêm phòng vaccine Vaxzevria [74], 5 nước thuộc EU/EEA đã bắt đầu khuyến cáo sử dụng liều thứ hai là một loại vaccine mRNA (Comirnaty hoặc Spikevax) ở đối tượng tiêm liều đầu tiên là vacccin Vaxzevria. Tại Đức, nơi biến thể Delta đang ngày một tăng lên, vào ngày 01 Tháng 6 năm 2021, Ủy ban Thường trực Tiêm phòng (STIKO) công bố một bản khuyến cáo nháp về sử dụng một vaccine mRNA là liều thứ hai cho toàn bộ người tiêm liều đầu tiên là Vaxzevria, bất kể tuổi và khoảng cách tối thiểu là 4 tuần giữa các liều [75].
Nhiều nghiên cứu đang đánh giá tính sinh miễn dịch và tính phản ứng của phối hợp liều mồi – tăng cường khác nhau, hầu hết nghiên cứu điều tra các phác đồ “hỗn hợp và phù hợp” của Vaxzevria với vaccine mRNA. Bằng chứng hiện nay sẵn có từ các nghiên cứu lâm sàng ngẫu nhiên và quan sát được tổng hợp ở dưới.
3.1. Dữ liệu từ các thử nghiên ngẫu nhiên.
ComCoV là một thử nghiệm đa trung tâm, mù đôi, ngẫu nhiên tại UK để đánh giá đáp ứng miễn dịch, hiệu quả và an toàn cho bốn phác đồ tiêm phòng vaccine COVID-19 mồi – tăng cường đồng hợp và dị hợp của vaccine Vaxzevria/Comirnaty (Vaxzevria/Vaxzevria, Vaxzevria/Comirnaty, Comirnaty/Comirnaty hoặc Comirnaty/Vaxzevria) với khoảng cách liều 4 tuần hoặc 12 tuần [76]. Nghiên cứu bắt đầu vào Tháng 01 năm 2021, lựa chọn những đối tượng từ 50 tuổi trở lên có bệnh lý nền từ nhẹ đến trung bình. Vào Tháng 4, thử nghiệm đã mở rộng ra loại vaccine là Skipevax và NVX-CoV2373 bởi Novavax.
Phân tích tính an toàn tạm thời, dựa vào phản hồi tự báo cáo triệu chứng toàn thân và khu trú thu thập bảy ngày sau liều đầu tiên và liều thứ hai, chỉ ra rằng cả phác đồ dị hợp có tính phản ứng hệ thống lớn hơn sau liều tiêm thứ hai so với những người tiêm theo phác đồ đồng hợp tương ứng. Tần xuất tăng lên của các tác dụng phụ như sốt, rét run, mệt mỏi, đau đầu, đau khớp, khó chịu, đau cơ đã được quan sát, nhưng không có người nào phải nhập viện do các triệu chứng đó, và thấy hầu như trong 48 giờ sau tiêm phòng [77]. Xa hơn, mục tiêu nghiên cứu là khoảng cách tiêm giữa liều thứ nhất và liều thứ hai là 4 tuần, không có sự khác biệt nào giữa các phác đồ tiêm phòng vaccine về tác dụng phụ không mong muốn trong vòng 28 ngày của liều thứ hai. Đến Tháng 6 năm 2021 (ngày khóa dữ liệu), toàn bộ đối tượng có bốn bến cố bất lợi nghiêm trọng ở toàn bộ các nhóm, không có biến cố nào liên quan đến tình trạng miễn dịch [78].
Với tính sinh miễn dịch, theo phân tích tính tương đương hoặc hơn giữa phác đồ tiêm dị hợp và đồng hợp, độ tập trung hình học trung bình (GMC) ngày 28 sau liều thứ hai của kháng thể IgG kháng gai SARS-CoV-2 ở phác đồ Vaxzevria/Comirnaty 12,906 ELU/ml) là ưu việt hơn phác đồ Vaxzevria/Vaxzevria (1,392 ELU/ml), với tỷ lệ trung bình hình học (GMR) là 9,2 (one-sided 97.5% CI: 7.5, ∞). Ở các đối tượng mồi bằng Comirnaty, nghiên cứu đã không cho thấy tính tương đương hoặc hơn của phác đồ tiêm dị hợp Comirnaty/Vaxzevria (GMC 7,133 ELU/ml) so với đồng hợp của mỗi loại (GMC 14,080 ELU/ml) với GMR là 0.51 (one-sided 97.5% CI: 0.43, ∞). Trung bình hình học của đáp ứng tế bào T ở ngày thứ 28 sau tiêm liều thứ hai ở nhóm Vaxzevria/Comirnaty là 185 SFC/106 PBMCs (tạo đốm tế bào/106 tế bào đơn nhân máu ngoại vi) (Spot Form Cell – SFC) so sánh với 50, 80 và 99 SFC/106 PBMC đối với Vaxzevria/Vaxzevria, Comirnaty/Comirnaty và Comirnaty/Vaxzevria, tương ứng [78]. Tổng hợp lại, đáp ứng kháng thể cao nhất quan sát được ở tiêm hai liều chuẩn Comirnaty, nhưng đáp ứng ở nhóm Vaxzevria/Comirnaty cũng cao tương đương. Ngoài ra, bất chấp phác đồ Comirnaty/Vaxzevria không đáp ứng tiêu chí tính tương đương hoặc hơn so với phác đồ tiêm dị hợp của mỗi loại, GMC của cả hai phác đồ tiêm đồng hợp vẫn cao hơn phác đồ tiêm đồng hợp Vaxzevria. Với phối hợp dị hợp Vaxzevria/Comirnaty cho thấy đáp ứng tế bào T cao nhất ở ngày thứ 28 sau liều thứ hai, tiếp theo là Comirnaty/Vaxzevria.
Bằng chứng khác đến từ nghiên cứu CombivacS [79], một thử nghiệm giai đoạn 2, mở nhãn, đối chứng ngẫu nhiên thực hiện vào Tháng 4 năm 2021 tại 5 bệnh viện đại học Tây Ban Nha với các đối tượng tuổi từ 18 đến 60. Đối tượng nghiên cứu (tuổi trung bình 44; 382 [57%] là nữ và 294 [43%] là nam) đã tiêm liều trước đó là Vaxzevria 8 đến 12 tuần trước khi lựa chọn và không bị nhiễm SARS-CoV-2 từ trước. Những đối tượng được chi ngẫu nhiên để tiêm Comirnaty (nhóm bệnh: 450) hoặc tiếp tục quan sát (nhóm chứng: 226). Phản ứng trong tuần đầu tiên sau khi tiêm Comirnaty như một liều thứ hai từ nhẹ đến trung bình. Những phản ứng bất lợi phổ biến nhất được báo cáo là đau ở vị trí tiêm, ủ rũ, đau đầu, đau cơ; và khoog có biến cố bất lợi nghiêm trọng nào. Nghiên cứu cũng đã chỉ ra rằng những đối tượng trong nhóm bệnh tăng đáng kể hiệu giá kháng thể trung bình hình học của kháng thể chuỗi gắn kết thụ thể [từ 71,5 BAU/mL (95% CI: 59,8-85,3) đến 7756,7 BAU/mL (95% CI: 7371,5–8162) và kháng thể IgG kháng protein gai [từ 98,4 BAU/mL (95% CI: 85,7-113) đến 3684,9 BAU/mL (3429,9– 3958,8)] 14 ngày sau tiêm Comirnaty như liều thứ hai sau liều đầu tiên là Vaxzevria. Giải thích các kết quả đó là liều thứ hai tiêm Comirnaty ở những người đã được tiêm Vaxzevria trước đó chỉ ra một đáp ứng miễn dịch mạnh mẽ, với hình thái có thể chấp nhận và có thể quản lý; dù thiếu yếu tố so sánh tiêm phòng vaccine đồng hợp trong nghiên cứu này.
3.2. Dữ liệu đến từ các nghiên cứu quan sát.
Một nghiên cứu quan sát (xuất bản trước) từ Đức thực hiện bảo Schmidt và cs [80] đã báo cáo rằng tính phản ứng và tính sinh miễn dịch từ quần hệ tiến cứu ở 216 đối tượng, chủ yếu là nhân viên y tế, không có tiền sử nhiễm SARS-CoV-2. Những đối tượng được chia vào nhóm phác đồ mồi – tăng cường dị hợp vector/mRNA (Vaxzevria/Comirnaty hoặc Vaxzevria/Spikevax) hoặc phác đồ đồng hợp tiêu chuẩn. Thời gian giữa hai lần tiêm là ngắn hơn cho mồi bằng mRNA (4.3±1.1 tuần) so với những đối tượng tiêm loại vector. Về tính phản ứng, cả hai loại biến cố tại chỗ và toàn thân là thấp hơn ở người tiêm đồng hợp vector/vector. Liều thứ hai của một loại vaccine mRNA là ít tương hợp hơn, và phổ biến cố bất lợi tại chỗ và toàn thân là tương đương quan sát được ở cả hai đối tượng được mồi bằng vector và mRNA. Mức độ kháng thể IgG đặc hiệu gai sau tiêm vaccine dị hợp là tương đương với nhóm tiêm vaccine đồng hợp mRNA/mRNA (3602 (IQR 3671) và 4932 (IQR 4189) BAU/ml tương ứng), trong khi đó mức độ IgG sau tiêm đồng hợp vector/vector thấp hơn đáng kể (404 (IQR 510) BAU/ml, p<0.0001). Sự khác biệt này quan sát cho hoạt tính kháng thể trung hòa định định lượng bằng xét nghiệm trung hòa thay thế. Phần lớn đối tượng tiêm vector/mRNA và mRNA/mRNA 100% hoạt tính ức chế, trong khi hoạt tính này thấp hơn đáng kể ở nhóm the vector/vector. Ngoài ra, phác đồ tiêm dị hợp vector/mRNA có tỷ lệ phần trăm tế bào T CD8 đặc hiệu cao nhất (0.28% (IQR 0.55%)), so với phác đồ tiêm đồng hợp vector/vector (0.04% (IQR 0.08%)) và mRNA/mRNA (0.06% (IQR 0.19)).
Bằng chứng xa hơn là sẵn có từ các nghiên cứu đoàn hệ tiến cứu quan sát (xuất bản trước) thực hiện bởi Hillus và cs [81] ở 340 nhân viên y tế được tiêm phòng giữa ngày 27 Tháng 12 năm 2020 đến ngày 21 Tháng 5 năm 2021 ở một trung tâm chăm sóc Berlin, Đức, tiêm hai liều Comirnaty trong 3 tuần hoặc tiêm một liều mồi Vaxzevria và liều tăng cường Comirnaty 10 đến 12 tuần sau. Kết quả cho thấy tính phản ứng của phác đồ tiêm dị hợp Vaxzevria/Comirnaty là lớn hơn tiêm đồng hợp Comirnaty và tương quan tốt. Có sự khác biệt đáng chú ý về giữa hai phác đồ ở phản ứng toàn thân, thường gặp hơn khi tiêm phòng mũi mồi Vaxzevria (86%; 95% CI: 79−91%), và ít gặp hơn ở liều tiêm liều hai bằng Comirnaty ở cả hai loại phác đồ tiêm phòng đồng hợp (65%; 95% CI: 56−72%) và dị hợp (48%, 95CI: 36−59%) hoặc tiêm liều mồi Comirnaty (38.76%; 95% CI: 31.9−46.1%). Không có phản ứng đe dọa tính mạng nào được báo cáo sau bất kỳ phác đồ nào trong nghiên cứu này. Đáp ứng kháng thể huyết thanh và tái hoạt hóa tế bào T là mạnh sau tiêm liều thứ hai ở cả hai phác đồ đồng hợp và dị hợp, và tính sinh miễn dịch toàn bộ là mạnh và có thể so sánh giữa hai phác đồ trong quần hệ này, với tăng nhẹ đáp ứng IgG S1 mong muốn và tế bào T sau liều thứ hai trong tiêm phòng dị hợp.
Một nghiên cứu quan sát nhỏ hơn (xuất bản trước), được thực hiện tại Đức bởi Gross và cs [82], ở một đoàn hệ 26 đối tượng ở độ tuổi 25 đến 46 (trung bình 30.6 tuổi) tiêm Vaxzevria là mũi mồi và sau đó tiêm Comirnaty ở khoảng cách tiêm là 8 tuần, đề nghị tằng phác đồ tiêm phòng dị hợp không liên quan đến các biến cố bất lợi và các phản ứng tụ báo cáo là cao hơn sau tiêm liều mồi Vaxzevria so với mũi tăng cường thứ hai Comirnat. Phác đồ dị hợp làm tăng đáng kể hiệu giá kháng thể hai tuần sau tiêm liều thứ hai và tăng hoạt hóa tế bào T. Một điểm đặc biệt thú vị là nghiên cứu đánh giá hoạt tính trung hòa của huyết thanh thu được sau hai tuần tiêm phòng đầy đủ chống lại các biến thể. Hoạt tính trung hòa chống lại biến thể Beta giảm hai lần so với biến thể Alpha, trong khi đó lại tương tự nhie biến thể Delta. Ngoài ra, đối với biến thể Alpha, hoạt tính trung hòa cao hơn 3.9 lần so với huyết thanh ở người tiêm đồng hợp vaccine Comirnaty.
Một nghiên cứu quan sát nữa từ Đức trên tính sinh miễn dịch của phác đồ dị hợp Vaxzevria/Comirnaty thực hiện bởi Barros-Martins và cs [83] ở nhân viên y tế trong nghiên cứu COVID-19 Contact (CoCo) Study tại Hannover Medical School. Nghiên cứu này lựa chọn người đã được tiêm Vaxzevria là liều thứ nhất mà không có nhiễm bệnh từ trước, 32 người tiêm đồng hợp và 55 người tiêm dị hợp với Comirnaty là liều thứ hai. Đáp ứng miễn dịch được đo trước và 3 tuần sau liều thứ hai. Sau liều thứ hai, phác đồ dị hợp Vaxzevria/Comirnaty tăng IgG anti-S 11.5 lần (P<0.0001), so sánh với tằng 2.9 lần sau tiêm theo phác đồ đồng hợp (P<0.0001). Những thãy đổi tương tự quan sát được đối với anti-S IgA, và cả nồng độ của hai kháng thể anti-S IgG và IgA sau phác đồ tiêm dị hợp đều nằm trong khỏng tiêm dị hợp với Comirnaty (nhóm so sánh từ nghiên cứu). Một xét nghiệm háp thụ miễn dịch liên kết men (ELISA) dựa trên trung hòa virus thay thế (sVNT) đã được sử dụng để xét nghiệm tính trung hòa của kháng thể. Trong khi phác đồ đồng hợp Vaxzevria tăng khả năng trung hòa biến thể Alpha ở một số đối tượng, nhung cho thấy không có tác dụng lên biến thể Beta và Gamma, phác đồ dị hợp có kháng thể trung hòa cao hơn chống lại toàn bộ biến thể được phân tích. Ngoài ra, tần xuất cho tế bào T CD4+ đặc hiệu với gai tăng ở cả hai nhóm sau liều thứ hai, nhưng tăng cao hơn đáng kể ở nhóm phác đồ dị hợp, như được quan sát ở những nghiên cứu khác.
3.3. Tổng hợp bằng chứng và khoảng trống chưa biết.
Bằng chứng từ các thử nghiệm đối chứng ngẫu nhiên trên tính an toàn của các phác đồ tiêm dị hợp ở người trên 50 tuổi được theo dõi đến 4 tuần đề nghị rằng các phác đồ “hỗn hợp và phù hợp” của Vaxzevria và Comirnaty có thể có tính phản ứng toàn thân cao hơn nhẹ trong tuần đầu tiên sau liều thứ hai khi so sánh với phác đồ đồng hợp, với triệu chứng chủ yếu xảy ra trong 48 giờ đầu tiên. Không có sự khác biệt nào được xác nhận ở biến cố bất lợi trong vòng 28 ngày sau liều thứ hai và không có biến cố bất lợi liên quan đến miễn dịch nghiêm trọng nào quan sát được. Toàn bộ, các triệu chứng là nhẹ đến trung bình và có thể quản lý được. Kết quả từ các nghiên cứu quan sát, chỉ có sẵn phác đồ dị hợp vector/mRNA, xác nhận các phát hiện đó hoặc chỉ ra rằng hình thái an toàn có thể so sánh lớn hơn với phác đồ đồng hợp và tương quan tốt. Mặt khác, bằng chứng trên tính an toàn kéo dài là thiếu và các nghiên cứu không đủ mẫu để phát hiến các biến cố nặng và hiếm hoặc đánh giá sự các khác biệt qua các nhóm tuổi và nhóm cộng đồng.
Về tính sinh miễn dịch, một thử nghiệm đối chứng ngẫu nhiên cho thấy bằng chứng sơ bộ rằng phác đồ tiêm phòng dị hợp của Vaxzevria và Comirnaty với liều thứ hai được tiêm sau 4 tuần cho thấy đáp ứng miễn dịch dịch thể cao. Cả hai phác đồ tiêm phòng dị hợp (Vaxzevria/Comirnaty; Comirnaty/Vaxzevria) cho thấy đáp ứng miễn dịch dịch thể và đáp ứng miễn dịch tế bào T cao hơn việc phối hợp đồng hợp. Các kết quả từ nghiên cứu quan sát chứng thực phát hiện đó. Tuy nhiên, bằng chứng vẫn còn hạn chế ở thời gian đáp ứng miễn dịch sau phác đồ dị hợp và, không có dữ liệu nào trên tính hiệu quả của các phác đồ đó ở mục đích phòng ngừa nhiễm bệnh, bệnh nặng và tử vong, bao gồm cả các nhóm tuổi hoặc các nhóm cộng đồng đặc biệt khác.
Dữ liệu trên tính phản ứng và tính sinh miễn dịch hiện nay sử dụng phác đồ tiêm phòng dị hợp là đáng khích lệ và cung cấp bằng chứng sơ bộ cho sử dụng “dấu nhãn” của các phác đồ đó. Mở rộng hợp, các nghiên cứu lâu dài là cần thiết, và tách biệt cho các nhóm cộng đồng khác nhau và các biến thể đáng quan tâm.
4. Các cân nhắc chương trình
4.1. Tiêm phòng vaccine một phần
Bằng chứng được lấy ra từ các nghiên cứu quan sát ở cả cộng đồng chung và các nhóm cộng đồng đặc biệt (như người cao tuổi, nhân viên y tế, người LTCF) xác nhận và mở rộng hơn nữa các phát hiện từ các thử nghiệm ngẫu nhiên cho thấy tiêm đầy đủ vaccine có khả năng bảo vệ cao hơn đáng kể so với chỉ tiêm một liều của những loại vaccine tiêm hai liều. Trong giai đoạn sớm của kế hoạch triển khai, trong bối cảnh lây truyền cộng đồng SARS-CoV-2 lan rộng, nhiều nước đã đưa ra chiến lược tiêm phòng vaccine với khoảng cách kéo dài hơn giữa liều tiêm thứ nhất và thứ hai để tối ưu nguồn cung cấp vaccine sẵn có và tối đa số người tiê ít nhất một liều vaccine để đảm bảo rằng họ được bảo vệ ít nhất là một phần chống loại COVID-19 [84].
Bằng chứng rằng các đối tượng chỉ tiêm một liều vaccine với loại vaccine tiêm hai liều là ít có khả năng bảo vệ chống lại nhiễm trùng có triệu chứng với biến thể Delta so với chống lại biến thể Alpha, và với biến thể Delta tăng sự tuần hoàn ở các nước EU/EEA, ECDC khuyên rằng tiêm đầy đủ cho toàn bộ các nhóm đang ở mức độ tăng nguy cơ bệnh COVID-19 nặng nên đạt được sớm nhất có thể. Tuy nhiên, những đối tượng ở nguy cơ cao của hậu quả bệnh nặng của SARS-CoV-2 nên nhận được liều tiêm thứ hai với khoảng cách ngắn nhất có thể sau khi tiêm liều đầu tiên [8]. Hiện tại ít nhất 8 nước (Séc, Đan Mạch, Tây Ban Nha, Croatia, Ai Len, Liechtensent, Na Uy, và Ba Lan) đã giảm thời gian giũa hai liều tiêm, trong khoảng thời gian cho phép để thúc đẩy tiêm phòng vaccine đầy đủ trong cộng đồng, đặc biệt ở những đối tượng có nguy cơ bệnh COVID-19 nặng cao hơn.
Cuối cùng, do những mâu thuẫn hiện tại trong việc tiêm vaccine, bao gồm số người đáng kể chỉ được tiêm một phần và do đó không thể bảo vệ một cách đầy đủ chống lại biến thể Delta, không có can thiệp không dùng thuốc nào được duy trì ở một mức độ đầy đủ để hạn chế lây truyền cộng đồng của biến thể này cho đến khi một số lượng người lớn hơn được tiêm phòng đầy đủ, tránh sự tăng lên của số lượng ca bệnh làm tăng nhập viện và tử vong.
4.2. Tiêm phòng vaccine một liều cho đối tượng đã bị nhiễm bệnh từ trước
Dựa trên những đánh giá gần đây của triển khai vaccine tại EU/EEA, các nước đã đưa ra các tiếp cận khác nhau bằng chính sách và thời gian cung cấp một liều vaccine sau khi nhiễm SARS-CoV-2 với khuyến cáo một liều ở 30 ngày sau nhiễm bệnh và có thể lên đến 8 tháng. Ngoài ra, xác thực nhiễm bệnh từ trước ở những đối tượng thay đổi theo từng nước, với một số nước yêu cầu PCR dương tính trong khi nước khác không yêu cầu bằng chứng nhiễm bệnh. Hơn nữa, ghi nhận tình trạng tiêm phòng vaccine của người nhiễm bệnh từ trước cung cấp với một liều vaccine cũng khác nhau giữa các nước [84].
Tài liệu nhiễm bệnh từ trước có thể là thách thức cho việc thực hiện, chấp nhận và khác nhau qua các vùng miền và quốc gia. Dù xét nghiệm huyết thanh hoạc nhaanh, việc thực hiện chỉ ngay trước khi tiêm một liều vaccine, có thể giúp đảm bảo tiếp cận phù hợp để xác thực nhiễm bệnh từ trước, độ chính xác của các xét nghiệm hiện nay sẽ yêu cẩu đánh giá cẩn thận – đặc biệt ở nơi mà khoảng cách giữa nhiễm bệnh trước đó và xét nghiệm huyết thanh học là kéo dài.
Sự xuất hiện của các biến thể tránh được miễn dịch, như biến thể Delta, và những biến thể trong tương lai, có thể yêu cầu cần liều vaccine thứ hai ở người đã được ghi nhận là nhiễm bệnh từ trước. Từ một một khía cạnh của chương trình, dù bằng chứng vẫn còn thiếu cho các chỉ tiêu lâm sàng cuối cừng và thời gian đáp ứng miễn dịch sinh ra nhờ phác đồ một liều ở người bị nhiễm bệnh từ trước, chú ý rằng nên tiếp tục liều tiêm thứ hai, đã được cho phép bởi EMA, như một chú ý. Điều này đặc biệt thích hợp cho người có nguy cơ hậu quả bệnh nặng sau khi nhiễm SARS-CoV-2 và dễ bị suy giảm khả năng miễn dịch hơn.
4.3. Các phác đồ tiêm phòng dị hợp
Theo tổng hợp của EMA của đặc tính sản phẩm cho toàn bộ các loại vaccine hai liều được cho phép sử dụng tại EU/EEA, chỉ phác đồ tiêp phòng đồng hợp là được khuyến cáo hiện nay. Tuy nhiên, phác đồ tiêm phòng dị hợp “dấu nhãn” được sử dụng ở nhiều nước EU/EEA dựa trên khuyến cáo của từng quốc gia, thường gặp hơn cả là liều thứ hai là vaccine mRNA (Comirnaty hoặc Spikevax) sau liều thứ nhất là Vaxzevria. Bằng chứng hiện nay cung cấp tổng quan khoa học để kỳ vọng các tiếp cận đó là an toàn và tạo đáp miễn dịch mạnh mẽ chống lại COVID-19.
Tính thay đổi nội tại của các chế phẩm vaccine qua sử dụng theo phác đồ dị hợp có thể linh hoạt lựa chọn vaccine để hạn chế các tác động lên triển khai vaccine trên một chế phẩm vaccine khi không có sẵn, bị dừng hoặc tạm dừng. Đặc biệt, ứng dụng này đến những đối tượng đã có những tác dụng phụ nặng, và người đã tiêm một mũi, nếu các hạn chế nhất định sau đó được thông qua ở mức độ một quốc gia (như tiêu chí về độ tuổi được tiêm Vaxzevria). Từ quan điểm vận hành, có lẽ phác đồ tiêm dị hợp có thể linh hoạt để giảm thiểu sự gián đoạn của chuỗi cung ứng vaccine hoặc thiếu hụt một số chế phẩm vaccine nhất định. Điều này có thể phù hợp hơn cho nững nước hạn chế tiếp cận vaccine, hoặc ở những nước mà các chế phẩm vaccine khác nhau chỉ sẵn có ở các thời điểm khác nhau. Mặt khác, thực hiện phác đồ tiêm dị hợp đưa ra các thách thức liên quan đến các yêu cầu logistic khác nhau của từng chế phẩm vaccine (vận chuyển biển, bảo quản, hạn sử dụng, vân vân) Logistic thích hợp cần được đặt ra nếu phác đồ tiêm dị hợp được sử dụng.
Dữ liệu cấp trên tính sinh miễn dịch của phác đồ tiêm phòng dị hợp có thể đưa ra các thông tin cân nhắc sử dụng trong tương lai ở nững nhóm cộng đồng đặc biệt (như người cao tuổi, người suy giảm miễn dịch) do các phát hiện sơ bộ của đáp ứng miễn dịch tế bào cao hơn. Tuy nhiên, bằng chứng trên tính sinh miễn dịch và tính hiệu quả của các phác đồ dị hợp trên nhóm đặc biệt và chống lại các biến thể đáng quan ngại là hạn chế hoặc không có. Nhiều dữ liệu hơn là cần thiết trên tính sinh miễn dịch và tính an toàn của tiêm liều tăng cường đồng hợp hoặc dị hợp sau khi hoàn thành tiêm phòng vaccine ban đầu đồng hợp hoặc dị hợp. Các nghiên cứu đang được tiếp tục để cung cấp nhiều bằng chứng hơn trên tính an toàn, tính sinh miễn dịch và tính hiệu quả của sử dụng chúng ở mức độ của các cơ quan quản lý và các chương trình tiêm phòng quốc gia.
4.4. Truyền thông nguy cơ
Với sự tuần hoàn đang tăng lên của biến thể Delta, truyền thông nỗ lực cần đặt tâm điểm lên tăng cường nhận thức của tầm quan trọng trong việc tiêm phòng đầy đủ để đảm bảo bảo vệ đầy đủ và, đối với vaccine hai liều, hoàn thành tiêm vaccine trong khỏng thời gian ngắn nhất có thể. Các chiến lược nên đánh giá cơ sở để nhận được tiêm phòng đầy đủ. Cộng đồng cần nhận thức được tiêm phòng đầy đủ là tối cần thiết, với các biến thể đáng quan ngại trở thành tác nhân lây truyền chính ở nhiều nước. Truyền thông nỗ lực và các nhóm cộng đồng ở nguy cơ cao nhất của bệnh nặng chưa được tiêm phòng đầy đủ khi các nhóm đó sẽ ít có khả năng bảo vệ hơn nhiều tránh nhiễm bệnh, bệnh nặng, và tử vong.
Các chiến lược để đảm bảo hiệu xuất cao của tiêm phòng vaccin đầy đủ bao gồm
– theo dõi sự tương thích của vaccine và các rào cản có khả năng thông qua nghiên cứu thông tin chi tiết về hành vi [85] (như các yếu tố ảnh hưởng đến hiệu xuất của liều thứ hai) đến các chiến lược truyền thông thông tin.
– sử dụng những hiểu biết về hành vi liên quan đến tuân thủ y tế để khuyến khích mọi người tiêm liều thứ hai (ví dụ: lập kế hoạch cho liều thứ hai, gửi lời nhắc, đóng khung liều thứ hai là tùy chọn mặc định) [86];
– cung cấp vaccine ở những nơi an toàn, quen thuộc và thuận tiện để tạo điều kiện cho việc chấp thuận [87];
– khuyến khích mọi người hỗ trợ gia đình và bạn bè, những người không chắc chắn về việc tiêm phòng, hoặc những người gặp khó khăn trong việc tiếp cận các dịch vụ [88];
– giải quyết các thông tin sai lệch có thể ảnh hưởng đến việc hấp thu vaccine [89].
Một thách thức về truyền thông trong thời kỳ đại dịch là cần phải thay đổi hoặc điều chỉnh các khuyến cáo, bao gồm cả vấn đề liên quan đến tiêm phòng (ví dụ: phác đồ tiêm, khoảng cách giữa các liều, các tiêu chí để được coi là tiêm phòng đầy đủ, sử dụng một loại vaccine khác để hoàn thành tiêm phòng, v.v.) trong bối cảnh của bằng chứng mới và đang phát triển.
Do đó, điều quan trọng là phải thừa nhận sự không chắc chắn, vì một số người có thể hiểu sai những thay đổi là dấu hiệu của sự kém năng lực hoặc sai lầm từ phía chính phủ hoặc các nhà khoa học [90]. Cần thông tin liên tục, rõ ràng và minh bạch tới công chúng, và cả với giới truyền thông, liên quan đến bất kỳ điều chỉnh nào được thực hiện, bao gồm giải thích về cơ sở lý luận đằng sau các quyết định và bản chất của các bằng chứng đang phát triển.
Mặc dù cần phải điều chỉnh việc triển khai vaccine phù hợp với bối cảnh năng động và những thay đổi trong dịch tễ học COVID-19, điều quan trọng là phải giảm thiểu những thay đổi đối với các khuyến nghị về tiêm phòng COVID-19 để duy trì niềm tin vaccine trong dân chúng và tránh nhận thức rằng có thiếu rõ ràng trong các thể chế có thẩm quyền.
KẾT LUẬN
Việc xem xét nhanh chóng các bằng chứng này cung cấp một cái nhìn tổng quan về hiểu biết hiện tại về các vấn đề mới nổi liên quan đến các chương trình tiêm phòng ở các nước EU / EEA. Đánh giá được thiết kế để tạo điều kiện cho các cuộc thảo luận về việc điều chỉnh các chính sách và chiến lược tiêm phòng quốc gia, dựa trên tình hình dịch tễ học hiện tại, nguồn cung cấp vaccine và bằng chứng khoa học liên quan đến vi rút và hiệu suất vaccine.
Với việc các biến thể thoát khỏi miễn dịch mới nổi đang trở nên thống trị ở nhiều quốc gia, việc tiêm phòng với một liều duy nhất cho các sản phẩm vaccine cần hai liều có thể giảm đáng kể khả năng bảo vệ chống lại bệnh vừa, nhiễm trùng và khả năng lây truyền sau này. Những người dễ bị tổn thương được tiêm phòng một phần có thể có ít khả năng bảo vệ hơn đáng kể, dẫn đến nhập viện, bệnh nặng và tử vong. Trong số những đối tượng đã bị nhiễm bệnh trước đó, việc tiêm phòng một liều có thể cung cấp khả năng sinh miễn dịch tương đương so với những người đã được tiêm phòng đầy đủ. Trong trường hợp không có mối tương quan về khả năng bảo vệ, vẫn chưa rõ liệu điều này có chuyển thành khả năng bảo vệ và thời gian bảo vệ có thể so sánh được hay không, đặc biệt là đối với các biến thể thoát miễn dịch. Trong bối cảnh này, việc đẩy nhanh triển khai vaccine là rất quan trọng để đảm bảo tỷ lệ tiêm phòng đầy đủ cho tất cả các nhóm dân cư có nguy cơ cao mắc COVID-19 nghiêm trọng.
Bằng chứng sơ bộ từ các nghiên cứu tiêm phòng phối hợp và phù hợp’ chỉ ra rằng các phác đồ trình dị hợp tạo ra phản ứng miễn dịch mạnh mẽ với khả năng tăng phản ứng sớm có thể xảy ra, mặc dù chưa có tính an toàn chính nào được xác định. Ngoài các chủ đề được quan tâm trong bài đánh giá này, tùy chọn liều ‘tăng cường’ sau tiêm phòng chính, (bao gồm nếu, khi nào và ai sẽ được lợi nhất) đang ngày càng trở thành một chủ đề thảo luận nổi bật và hiện cũng đang được điều tra. Tuy nhiên, bằng chứng hiện vẫn còn hạn chế. ECDC sẽ tiếp tục theo dõi, thu thập và phổ biến thông tin cập nhật về những vấn đề quan trọng này và các chủ đề mới khác được quan tâm, để hỗ trợ việc ra quyết định ở các nước EU / EEA và tạo điều kiện thuận lợi cho việc sửa đổi và điều chỉnh các chính sách và chiến lược tiêm phòng COVID-19
ĐÓNG GÓP
ECDC experts (in alphabetical order): Kim Brolin, Orlando Cenciarelli, Edoardo Colzani, Marlena Kaczmarek, Nathalie Nicolay, Kate Olsson, Ajibola Omokanye, Lucia Pastore Celentano, Anastasia Pharris, Diamantis Plachouras, Giovanni Ravasi, Andrea Würz.
Marco Cavaleri of the European Medicines Agency (EMA) provided a helpful review of the document
TÀI LIỆU THAM KHẢO
- European Medicines Agency (EMA). COVID-19 vaccines: Amsterdam: EMA; 2021. Available at: https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid- 19/treatments-vaccines/vaccines-covid-19/covid-19-vaccines-authorised#authorised-covid-19-vaccines-section
- European Medicines Agency (EMA). Comirnaty – COVID-19 mRNA vaccine (nucleoside-modified). Amsterdam: EMA; 2021. Available at: https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty
- European Medicines Agency (EMA). First COVID-19 vaccine approved for children aged 12 to 15 in EU. Amsterdam: EMA; 2021. Available at: https://www.ema.europa.eu/en/news/first-covid-19-vaccine- approved-children-aged-12-15-eu
- European Medicines Agency (EMA). COVID-19 Vaccine Moderna – COVID-19 mRNA Vaccine (nucleoside modified). Amsterdam: EMA; 2021. Available at: https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-moderna
- European Medicines Agency (EMA). Vaxzevria (previously COVID-19 Vaccine AstraZeneca) – COVID-19 Vaccine (ChAdOx1-S [recombinant]). Amsterdam: EMA; 2021. Available at: https://www.ema.europa.eu/en/medicines/human/EPAR/vaxzevria-previously-covid-19-vaccine-astrazeneca
- European Commission (EC). Communication from the Commission to the European Parliament and the Council. A united front to beat COVID-19. Brussels: EC; 2021. Available at: https://ec.europa.eu/info/sites/info/files/communication-united-frontbeat-covid-19_en.pdf
- European Centre for Disease Prevention and Control (ECDC). The COVID-19 Vaccine Tracker. Stockholm: ECDC; 2021. Available at: https://vaccinetracker.ecdc.europa.eu/public/extensions/COVID-19/vaccine-html#uptake-tab
- European Centre for Disease Prevention and Control (ECDC). Threat Assessment Brief: Implications for the EU/EEA on the spread of the SARS-CoV-2 Delta (B.1.617.2) variant of Stockholm: ECDC; 2021. Available at: https://www.ecdc.europa.eu/en/publications-data/threat-assessment-emergence-and-impact-sars-cov-2-delta-variant
- European Centre for Disease Prevention and Control (ECDC). COVID-19 country overviews. Stockholm: ECDC; 2021. Available at: https://covid19-country-overviews.ecdc.europa.eu/
- S. Food & Drug Administration – Vaccines and Related Biological Products Advisory Committee Meeting. FDA Review of Efficacy and Safety of Pfizer-BioNTech COVID-19 Vaccine Emergency Use Authorization Request. 2020. Available at: https://www.fda.gov/media/144337/download
- S. Food & Drug Administration – Vaccines and Related Biological Products Advisory Committee Meeting. Briefing Document – Moderna COVID-19 Vaccine. Silver Spring: FDA; 2020. Available at: https://www.fda.gov/media/144434/download
- Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. New England Journal of Medicine. 2021;384(5):403-16. Available at: https://www.nejm.org/doi/full/10.1056/nejmoa2035389
- Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Single-Liều administration and the influence of the timing of the booster Liều on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. The Lancet. 2021;397(10277):881-91. Available at: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)00432-3/fulltext
- Dagan N, Barda N, Kepten E, Miron O, Perchik S, Katz MA, et al. BNT162b2 mRNA Covid-19 vaccine in a nationwide mass vaccination setting. New England Journal of Medicine. 2021;384(15):1412-23. Available at: https://www.nejm.org/doi/full/10.1056/nejmoa2101765
- Chodcik G, Tene L, Patalon T, Gazit S, Ben-Tov A, Cohen D, et al. The effectiveness of the first Liều of BNT162 b 2 vaccine in reducing SARS-CoV-2 infection 13-24 days after immunization: real-world evidence. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.01.27.21250612. Available at: https://www.medrxiv.org/content/10.1101/2021.01.27.21250612v1
- Haas EJ, Angulo FJ, McLaughlin JM, Anis E, Singer SR, Khan F, et al. Impact and effectiveness of mRNA BNT162b2 vaccine against SARS-CoV-2 infections and COVID-19 cases, hospitalisations, and deaths following a nationwide vaccination campaign in Israel: an observational study using national surveillance data. The Lancet. 2021;397(10287):1819-29. Available at: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)00947-8/fulltext
- Heymann AD, Zacay G, Shasha D, Bareket R, Kadim I, Sikron FH, et al. BNT162b2 Vaccine Effectiveness in Preventing Asymptomatic Infection with SARS-CoV-2 Virus: A Nationwide Historical Cohort Study. Preprint The Lancet [Preprint]. 2021. DOI: 10.2139/ssrn.3796868. Available at: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3796868
- Goldberg Y, Mandel M, Woodbridge Y, Fluss R, Novikov I, Yaari R, et al. Protection of previous SARS-CoV-2 infection is similar to that of BNT162b2 vaccine protection: A three-month nationwide experience from Israel. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.04.20.21255670. Available at: https://www.medrxiv.org/content/10.1101/2021.04.20.21255670v1
- Tande AJ, Pollock BD, Shah ND, Farrugia G, Virk A, Swift M, et al. Impact of the COVID-19 vaccine on asymptomatic infection among patients undergoing pre-procedural COVID-19 molecular screening. Clinical Infectious Diseases [Preprint]. 2021. DOI: 10.1093/cid/ciab229. Available at: https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciab229/6167855
- Andrejko K, Pry J, Myers JF, Jewell NP, Openshaw J, Watt J, et al. Early evidence of COVID-19 vaccine effectiveness within the general population of California. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.04.08.21255135. Available at: https://www.medrxiv.org/content/10.1101/2021.04.08.21255135v1
- Martínez-Baz I, Miqueleiz A, Casado I, Navascués A, Trobajo-Sanmartín C, Burgui C, et al. Effectiveness of COVID-19 vaccines in preventing SARS-CoV-2 infection and hospitalisation, Navarre, Spain, January to April 2021. Euro Surveill. 2021;26(21):2100438. Available at: https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2021.26.21.2100438
- Björk J, Inghammar M, Moghaddassi M, Rasmussen M, Malmqvist U, Kahn F. Effectiveness of the BNT162b2 vaccine in preventing COVID-19 in the working age population – first results from a cohort study in Southern Sweden. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.04.20.21254636. Available at: https://www.medrxiv.org/content/10.1101/2021.04.20.21254636v1
- Emborg H-D, Valentiner-Branth P, Schelde AB, Nielsen KF, Gram MA, Moustsen-Helms IR, et al. Vaccine effectiveness of the BNT162b2 mRNA COVID-19 vaccine against RT-PCR confirmed SARS-CoV-2 infections, hospitalisations and mortality in prioritised risk groups. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.05.27.21257583. Available at: https://www.medrxiv.org/content/10.1101/2021.05.27.21257583v1
- Moustsen-Helms IR, Emborg H-D, Nielsen J, Nielsen KF, Krause TG, Mølbak K, et al. Vaccine effectiveness after 1st and 2nd Liều of the BNT162b2 mRNA Covid-19 Vaccine in long-term care facility residents and healthcare workers – a Danish cohort study. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.03.08.21252200. Available at: https://www.medrxiv.org/content/10.1101/2021.03.08.21252200v1
- Britton A, Slifka KMJ, Edens C, Nanduri SA, Bart SM, Shang N, et al. Effectiveness of the Pfizer-BioNTech COVID-19 vaccine among residents of two skilled nursing facilities experiencing COVID-19 outbreaks— Connecticut, December 2020–February 2021. Morbidity and Mortality Weekly Report. 2021;70(11):396. Available at: https://www.cdc.gov/mmwr/volumes/70/wr/mm7011e3.htm
- Tenforde MW. Effectiveness of Pfizer-BioNTech and Moderna Vaccines Against COVID-19 Among Hospitalized Adults Aged≥ 65 Years—United States, January–March 2021. MMWR. 2021;70(18):674-9. Available at: https://www.cdc.gov/mmwr/volumes/70/wr/mm7018e1.htm
- Bernal JL, Andrews N, Gower C, Robertson C, Stowe J, Tessier E, et al. Effectiveness of the Pfizer-BioNTech and Oxford-AstraZeneca vaccines on covid-19 related symptoms, hospital admissions, and mortality in older adults in England: test negative case-control study. BMJ. 2021;373:n1088. Available at: https://www.bmj.com/content/373/bmj.n1088
- Shrotri M, Krutikov M, Palmer T, Giddings R, Azmi B, Subbarao S, et al. Vaccine effectiveness of the first Liều of ChAdOx1 nCoV-19 and BNT162b2 against SARS-CoV-2 infection in residents of long-term care facilities in England (VIVALDI): a prospective cohort study. The Lancet Infectious Diseases [Preprint]. 2021. DOI: 10.1016/S1473-3099(21)00289-9. Available at: https://www.sciencedirect.com/science/article/pii/S1473309921002899
- Mazagatos C, Monge S, Olmedo C, Vega L, Gallego P, Martín-Merino E, et al. Effectiveness of mRNA COVID- 19 vaccines in preventing SARS-CoV-2 infections and COVID-19 hospitalisations and deaths in elderly long- term care facility residents, Spain, weeks 53 2020 to 13 2021. Euro Surveill. 2021;26(24):2100452. Available at: https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2021.26.24.2100452
- Monge S, Olmedo C, Alejos B, Lapena M, Sierra MJ, Limia A. Direct and indirect effectiveness of mRNA vaccination against SARS-CoV-2 infection in long-term care facilities in Spain. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.04.08.21255055. Available at: https://www.medrxiv.org/content/10.1101/2021.04.08.21255055v2
- Lumley SF, Rodger G, Constantinides B, Sanderson N, Chau KK, Street TL, et al. An observational cohort study on the incidence of SARS-CoV-2 infection and B.1.1.7 variant infection in healthcare workers by antibody and vaccination status. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.03.09.21253218. Available at: https://www.medrxiv.org/content/10.1101/2021.03.09.21253218v1
- Hall VJ, Foulkes S, Saei A, Andrews N, Oguti B, Charlett A, et al. COVID-19 vaccine coverage in health-care workers in England and effectiveness of BNT162b2 mRNA vaccine against infection (SIREN): a prospective, multicentre, cohort study. The Lancet. 2021;397(10286):1725-35. Available at: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)00790-X/fulltext
- Thompson MG, Burgess JL, Naleway AL, Tyner HL, Yoon SK, Meece J, et al. Interim estimates of vaccine effectiveness of BNT162b2 and mRNA-1273 COVID-19 vaccines in preventing SARS-CoV-2 infection among health care personnel, first responders, and other essential and frontline workers—eight US locations, December 2020–March 2021. Morbidity and Mortality Weekly Report. 2021;70(13):495. Available at: https://www.cdc.gov/mmwr/volumes/70/wr/mm7013e3.htm
- Swift MD, Breeher LE, Tande AJ, Tommaso CP, Hainy CM, Chu H, et Effectiveness of mRNA COVID-19 vaccines against SARS-CoV-2 infection in a cohort of healthcare personnel. Clinical Infectious Diseases [Preprint]. 2021. DOI: 10.1093/cid/ciab361. Available at: https://academic.oup.com/cid/advance- article/doi/10.1093/cid/ciab361/6253721?login=true
- Angel Y, Spitzer A, Henig O, Saiag E, Sprecher E, Padova H, et Association between vaccination with BNT162b2 and incidence of symptomatic and asymptomatic SARS-CoV-2 infections among healthcare workers. JAMA. 2021;325(24):2457-65. Available at: https://jamanetwork.com/journals/jama/fullarticle/2779853
- Tang L, Hijano DR, Gaur AH, Geiger TL, Neufeld EJ, Hoffman JM, et al. Asymptomatic and symptomatic SARS-CoV-2 infections after BNT162b2 vaccination in a routinely screened workforce. JAMA. 2021;325(24):2500-2. Available at: https://jamanetwork.com/journals/jama/fullarticle/2779854
- Fabiani M, Ramigni M, Gobbetto V, Mateo-Urdiales A, Pezzotti P, Piovesan Effectiveness of the Comirnaty (BNT162b2, BioNTech/Pfizer) vaccine in preventing SARS-CoV-2 infection among healthcare workers, Treviso province, Veneto region, Italy, 27 December 2020 to 24 March 2021. Eurosurveillance. 2021;26(17):2100420. Available at: https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2021.26.17.2100420
- Pilishvili T, Fleming-Dutra KE, Farrar JL, Gierke R, Mohr NM, Talan DA, et al. Interim Estimates of Vaccine Effectiveness of Pfizer-BioNTech and Moderna COVID-19 Vaccines Among Health Care Personnel—33 US Sites, January–March 2021. Morbidity and Mortality Weekly Report. 2021;70(20):753. Available at: https://www.cdc.gov/mmwr/volumes/70/wr/mm7020e2.htm
- Planas D, Veyer D, Baidaliuk A, Staropoli I, Guivel-Benhassine F, Rajah M, et al. Reduced sensitivity of infectious SARS-CoV-2 variant B. 1.617. 2 to monoclonal antibodies and sera from convalescent and vaccinated individuals. bioRxiv [Preprint]. 2021. DOI: 10.1101/2021.05.26.445838. Available at: https://www.biorxiv.org/content/10.1101/2021.05.26.445838v1.abstract
- Yadav PD, Sapkal GN, Ella R, Sahay RR, Nyayanit DA, Patil DY, et al. Neutralization against B.1.351 and
B.1.617.2 with sera of COVID-19 recovered cases and vaccinees of BBV152. bioRxiv [Preprint]. 2021. DOI: 10.1101/2021.06.05.447177. Available at: https://www.biorxiv.org/content/10.1101/2021.06.05.447177v1
- Liu C, Ginn HM, Dejnirattisai W, Supasa P, Wang B, Tuekprakhon A, et al. Reduced neutralization of SARS- CoV-2 B. 1.617 by vaccine and convalescent serum. Cell [Preprint]. 2021. DOI: 10.1016/j.cell.2021.06.020. Available at: https://www.sciencedirect.com/science/article/pii/S0092867421007558
- Nasreen S, He S, Chung H, Brown KA, Gubbay JB, Buchan SA, et al. Effectiveness of COVID-19 vaccines against variants of concern, Canada. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.06.28.21259420. Available at: https://www.medrxiv.org/content/10.1101/2021.06.28.21259420v1
- Bernal JL, Andrews N, Gower C, Gallagher E, Simmons R, Thelwall S, et al. Effectiveness of COVID-19 vaccines against the B. 1.617. 2 variant. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.05.22.21257658. Available at: https://www.medrxiv.org/content/10.1101/2021.05.22.21257658v1
- Sheikh A, McMenamin J, Taylor B, Robertson C. SARS-CoV-2 Delta VOC in Scotland: demographics, risk of hospital admission, and vaccine effectiveness. The Lancet. 2021;397(10293):2461-2. Available at: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)01358-1/fulltext
- Abu-Raddad LJ, Chemaitelly H, Butt AA. Effectiveness of the BNT162b2 Covid-19 Vaccine against the B. 1.1. 7 and B. 1.351 Variants. New England Journal of Medicine. 2021. Available at: https://www.nejm.org/doi/full/10.1056/NEJMc2104974
- Stowe J, Andrews N, Gower C, Gallagher E, Utsi L, Simmons R, et al. Effectiveness of COVID-19 vaccines against hospital admission with the Delta (B. 1.617. 2) variant. kHub [Preprint]. 2021. Available at: https://khub.net/documents/135939561/479607266/Effectiveness+of+COVID- 19+vaccines+against+hospital+admission+with+the+Delta+%28B.1.617.2%29+variant.pdf/1c213463- 3997-ed16-2a6f-14e5deb0b997?t=1623689315431
- Chung H, He S, Nasreen S, Sundaram M, Buchan S, Wilson S, et al. Effectiveness of BNT162b2 and mRNA- 1273 COVID-19 vaccines against symptomatic SARS-CoV-2 infection and severe COVID-19 outcomes in Ontario, Canada. Preprints with The Lancet [Preprint]. 2021. DOI: 10.2139/ssrn.3845993. Available at: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3845993
- Skowronski DM, Setayeshgar S, Zou M, Prystajecky N, Tyson JR, Galanis E, et Single-Liều mRNA vaccine effectiveness against SARS-CoV-2, including P. 1 and B. 1.1. 7 variants: a test-negative design in adults 70 years and older in British Columbia, Canada. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.06.07.21258332. Available at: https://www.medrxiv.org/content/10.1101/2021.06.07.21258332v1
- Jones NK, Rivett L, Seaman S, Samworth RJ, Warne B, Workman C, et al. Single-Liều BNT162b2 vaccine protects against asymptomatic SARS-CoV-2 infection. eLife. 2021;10:e68808. Available at: https://elifesciences.org/articles/68808
- S. Food and Drug Administration (FDA). Letter to Pfizer Inc. 2021. Available at: https://www.fda.gov/media/144412/download
- Angyal A, Longet S, Moore S, Payne RP, Harding A, Tipton T, et al. T-Cell and Antibody Responses to First BNT162b2 Vaccine Liều in Previously SARS-CoV-2-Infected and Infection-Naive UK Healthcare Workers: A Multicentre, Prospective, Observational Cohort Study. Preprint The Lancet [Preprint]. 2021. DOI: 10.2139/ssrn.3812375. Available at: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3812375
- Reynolds CJ, Pade C, Gibbons JM, Butler DK, Otter AD, Menacho K, et al. Prior SARS-CoV-2 infection rescues B and T cell responses to variants after first vaccine Liều. Science. 2021;372(6549):1418-23. Available at: https://science.sciencemag.org/content/372/6549/1418.abstract
- Bradley T, Grundberg E, Selvarangan R. Antibody responses boosted in seropositive healthcare workers after single Liều of SARS-CoV-2 mRNA vaccine. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.02.03.21251078. Available at: https://www.medrxiv.org/content/10.1101/2021.02.03.21251078v1.full
- Ebinger JE, Fert-Bober J, Printsev I, Wu M, Sun N, Prostko JC, et al. Antibody responses to the BNT162b2 mRNA vaccine in individuals previously infected with SARS-CoV-2. Nat Med. 2021;27(6):981-4. Available at: https://www.nature.com/articles/s41591-021-01325-6
- Manisty C, Otter AD, Treibel TA, McKnight A, Altmann DM, Brooks T, et al. Antibody response to first BNT162b2 Liều in previously SARS-CoV-2-infected Lancet. 2021;397(10279):1057-8. Available at: https://www.sciencedirect.com/science/article/pii/S0140673621005018
- Samanovic MI, Cornelius AR, Wilson JP, Karmacharya T, Gray-Gaillard SL, Allen JR, et al. Poor antigen- specific responses to the second BNT162b2 mRNA vaccine Liều in SARS-CoV-2-experienced individuals. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.02.07.21251311. Available at: https://www.medrxiv.org/content/10.1101/2021.02.07.21251311v2
- Levi R, Azzolini E, Pozzi C, Ubaldi L, Lagioia M, Mantovani A, et al. A cautionary note on recall vaccination in ex-COVID-19 subjects. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.02.01.21250923. Available at: https://www.medrxiv.org/content/10.1101/2021.02.01.21250923v2
- Tut G, Lancaster T, Krutikov M, Sylla P, Bone D, Kaur N, et al. Profile of Humoral and Cellular Immune Responses to Single BNT162b2 or ChAdOx1 Vaccine in Residents and Staff Within Residential Care Homes (VIVALDI Study). Preprints with The Lancet [Preprint]. 2021. DOI: 10.2139/ssrn.3839453. Available at: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3839453
- Ciccone EJ, Zhu DR, Ajeen R, Lodge EK, Shook-Sa BE, Boyce RM, et al. SARS-CoV-2 seropositivity after infection and antibody response to mRNA-based vaccination. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.02.09.21251319. Available at: https://www.medrxiv.org/content/10.1101/2021.02.09.21251319v1
- Goel RR, Apostolidis SA, Painter MM, Mathew D, Pattekar A, Kuthuru O, et al. Distinct antibody and memory B cell responses in SARS-CoV-2 naïve and recovered individuals following mRNA vaccination. Science Immunology. 2021;6(58):eabi6950. Available at: https://immunology.sciencemag.org/content/6/58/eabi6950.abstract
- Saadat S, Rikhtegaran Tehrani Z, Logue J, Newman M, Frieman MB, Harris AD, et al. Binding and Neutralization Antibody Titers After a Single Vaccine Liều in Health Care Workers Previously Infected With SARS-CoV-2. JAMA. 2021;325(14):1467-9. Available at: https://jamanetwork.com/journals/jama/fullarticle/2777171
- Stamatatos L, Czartoski J, Wan Y-H, Homad LJ, Rubin V, Glantz H, et al. mRNA vaccination boosts cross- variant neutralizing antibodies elicited by SARS-CoV-2 infection. Science. 2021;372(6549):1413-8. Available at: https://science.sciencemag.org/content/372/6549/1413
- Krammer F, Srivastava K, Alshammary H, Amoako AA, Awawda MH, Beach KF, et al. Antibody Responses in Seropositive Persons after a Single Liều of SARS-CoV-2 mRNA Vaccine. New England Journal of Medicine. 2021;384(14):1372-4. Available at: https://www.nejm.org/doi/full/10.1056/NEJMc2101667
- Havervall S, Marking U, Greilert-Norin N, Ng H, Salomonsson A-C, Hellström C, et al. Antibody Responses After a Single Liều of ChAdOx1 nCoV-19 Vaccine in Healthcare Workers Previously Infected with SARS- CoV-2. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.05.08.21256866. Available at: https://www.medrxiv.org/content/10.1101/2021.05.08.21256866v1
- Wei J, Stoesser N, Matthews PC, Studley R, Bell I, Bell JI, et The impact of SARS-CoV-2 vaccines on antibody responses in the general population in the United Kingdom. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.04.22.21255911. Available at: https://www.medrxiv.org/content/10.1101/2021.04.22.21255911v1
- Dolgin E. Is one vaccine Liều enough if you’ve had COVID? What the science says. Nature Publishing Group; 2021. Available at: https://www.nature.com/articles/d41586-021-01609-4
- Krammer F. A correlate of protection for SARS-CoV-2 vaccines is urgently needed. Nature Medicine. 2021. Available at: https://doi.org/10.1038/s41591-021-01432-4
- Kardani K, Bolhassani A, Shahbazi S. Prime-boost vaccine strategy against viral infections: mechanisms and benefits. Vaccine. 2016;34(4):413-23. Available at: https://pubmed.ncbi.nlm.nih.gov/26691569/
- Gilca V, Sauvageau C, Panicker G, De Serres G, Ouakki M, Unger ER. Immunogenicity and safety of a mixed vaccination schedule with one Liều of nonavalent and one Liều of bivalent HPV vaccine versus two Liềus of nonavalent vaccine–A randomized clinical trial. Vaccine. 2018;36(46):7017-24. Available at: https://www.sciencedirect.com/science/article/pii/S0264410X18313264
- Shukarev G, Callendret B, Luhn K, Douoguih M, EBOVAC1 consortium. A two-Liều heterologous prime- boost vaccine regimen eliciting sustained immune responses to Ebola Zaire could support a preventive strategy for future outbreaks. Human Vaccines & Immunotherapeutics. 2017;13(2):266-70. Available at: https://www.tandfonline.com/doi/full/10.1080/21645515.2017.1264755
- Ledford H. Could mixing COVID vaccines boost immune response? Nature Publishing Group. 2021. Available at: https://www.nature.com/articles/d41586-021-00315-5
- He Q, Mao Q, An C, Zhang J, Gao F, Bian L, et al. Heterologous prime-boost: breaking the protective immune response bottleneck of COVID-19 vaccine candidates. Emerging Microbes & Infections. 2021;10(1):629-37. Available at: https://www.tandfonline.com/doi/full/10.1080/22221751.2021.1902245
- Spencer AJ, McKay PF, Belij-Rammerstorfer S, Ulaszewska M, Bissett CD, Hu K, et al. Heterologous vaccination regimens with self-amplifying RNA and adenoviral COVID vaccines induce robust immune responses in mice. Nature communications. 2021;12(1):1-8. Available at: https://www.nature.com/articles/s41467-021-23173-1
- European Medicines Agency (EMA). AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets. Amsterdam: EMA; 2021. Available at:ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare- casesunusual-blood-clots-low-blood
- Robert Koch Institut. Mitteilung der STIKO zur COVID-19-Impfung: Impfabstand und heterologes Impfschema nach Erstimpfung mit Vaxzevria. 2021. Available at: https://www.rki.de/DE/Content/Kommissionen/STIKO/Empfehlungen/PM_2021-07-01.html
- University of Oxford. Com-Cov. Comparing COVID-19 Vaccine schedule combinations. 2021. Available at: https://comcovstudy.org.uk/home
- Shaw RH, Stuart A, Greenland M, Liu X, Van-Tam JSN, Snape MD. Heterologous prime-boost COVID-19 vaccination: initial reactogenicity data. The Lancet. 2021;397(10289):2043-6. Available at: https://www.thelancet.com/journals/lancet/article/PIIS0140-67362101115-6/fulltext
- Liu X, Shaw RH, Stuart AS, Greenland M, Dinesh T, Provstgaard-Morys S, et al. Safety and Immunogenicity Report from the Com-COV Study–a Single-Blind Randomised Non-Inferiority Trial Comparing Heterologous And Homologous Prime-Boost Schedules with An Adenoviral Vectored and mRNA COVID-19 Vaccine. Preprints with The Lancet [Preprint]. 2021. Available at: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3874014
- Borobia AM, Carcas AJ, Pérez-Olmeda M, Castaño L, Bertran MJ, García-Pérez J, et al. Immunogenicity and reactogenicity of BNT162b2 booster in ChAdOx1-S-primed participants (CombiVacS): a multicentre, open- label, randomised, controlled, phase 2 trial. The Lancet [Preprint]. 2021. DOI: 10.1016/S0140- 6736(21)01420-3. Available at: https://www.thelancet.com/journals/lancet/article/PIIS0140- 6736(21)01420-3/fulltext
- Schmidt T, Klemis V, Schub D, Mihm J, Hielscher F, Marx S, et al. Immunogenicity and reactogenicity of a heterologous COVID-19 prime-boost vaccination compared with homologous vaccine regimens. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.06.13.21258859. Available at: https://www.medrxiv.org/content/10.1101/2021.06.13.21258859v1
- Hillus D, Schwarz T, Tober-Lau P, Hastor H, Thibeault C, Kasper S, et al. Safety, reactogenicity, and immunogenicity of homologous and heterologous prime-boost immunisation with ChAdOx1-nCoV19 and BNT162b2: a prospective cohort study. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.05.19.21257334. Available at: https://www.medrxiv.org/content/10.1101/2021.05.19.21257334v2.full
- Gross R, Zanoni M, Seidel A, Conzelmann C, Gilg A, Krnavek D, et al. Heterologous ChAdOx1 nCoV-19 and BNT162b2 prime-boost vaccination elicits potent neutralizing antibody responses and T cell reactivity. medRxiv [Preprint]. 2021. DOI: 10.1101/2021.05.30.21257971. Available at: https://www.medrxiv.org/content/10.1101/2021.05.30.21257971v1
- Barros-Martins J, Hammerschmidt SI, Cossmann A, Odak I, Stankov MV, Morillas Ramos G, et al. Immune responses against SARS-CoV-2 variants after heterologous and homologous ChAdOx1 nCoV-19/BNT162b2 vaccination. Nat Med. 2021. Available at: https://www.nature.com/articles/s41591-021-01449-9
- European Centre for Disease Prevention and Control (ECDC). Overview of the implementation of COVID-19 vaccination strategies and vaccine deployment plans in the EU/EEA. Stockholm: ECDC; 2021. Available at: https://www.ecdc.europa.eu/en/publications-data/overview-implementation-covid-19-vaccination- strategies-and-deployment-plans
- European Centre for Disease Prevention and Control (ECDC). Behavioural Insights research to support the response to COVID-19: a survey of implementation in the EU/EEA. Stockholm: ECDC; 2021. Available at: https://www.ecdc.europa.eu/en/publications-data/behavioural-insights-research-support-response-covid-19
- Local Government Association. Second vaccine jab compliance. 2021. Available at: https://www.local.gov.uk/our-support/coronavirus-information-councils/covid-19-service-information/covid- 19-vaccinations/behavioural-insights/resources/second-vaccine-jab-compliance
- Schoch-Spana M, Brunson EK, Long R, Ruth A, Ravi SJ, Trotochaud M, et al. The public’s role in COVID-19 vaccination: Human-centered recommendations to enhance pandemic vaccine awareness, access, and acceptance in the United States. Vaccine [Preprint]. 2020. DOI: 10.1016/j.vaccine.2020.10.059. Available at: https://www.sciencedirect.com/science/article/pii/S0264410X20313682
- Centres for Disease Control and Prevention (CDC). Talking about Vaccines. Atlanta: CDC; 2021. Available at: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/talk-about-vaccines.html
- Lewandowsky S, Cook J, Schmid P, Holford DL, Finn A, Leask J, et al. The COVID-19 Vaccine Communication Handbook. A practical guide for improving vaccine communication and fighting misinformation. SciBeh; 2021. Available at: http://repository.essex.ac.uk/29625/
- National Academies of Sciences, Engineering, Medicine. Strategies for building confidence in the COVID-19 Vaccines. Washington, DC: The National Academies Press; 2021. Available at: https://www.nap.edu/catalog/26068/strategies-for-building-confidence-in-the-covid-19-vaccines